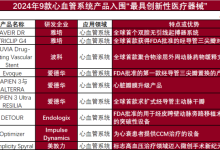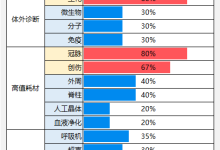
第一部分 主要内容概述
该指导原则旨在帮助企业建立健全符合规范要求的质量管理体系,确保医疗器械经营活动中产品的质量安全。检查内容涵盖了质量管理体系的建立与改进、职责与制度、人员与培训、设施与设备、采购、收货与验收、入库、贮存与检查、销售、出库与运输以及售后服务等多个方面。特别强调了企业在质量管理方面的职责,如依法履行质量安全责任、提供必要的资源和制度保障、确保质量安全关键岗位人员有效履行职责等。此外,还明确了企业应具备的质量管理体系文件、组织机构、人员配置、设施设备等方面的条件和要求。文中通过对具体条款的解读和应用指导,为企业如何进行自我检查、整改提供了明确的路径和方法,意在提升医疗器械经营企业的质量管理能力和水平,保障公众健康安全。

导图可微信公众号内回复 检查导图 获得。
第二部分 医疗器械经营许可(含变更和延续)现场核查
1. 检查结果评定:
- 对于医疗器械经营企业经营许可(含变更和延续)的现场核查,若企业适用的所有项目均符合要求或者能够在检查过程中立即整改完成的,检查结果为“通过检查”。
- 若关键项目(标识为“※”项)中不符合要求的项目数不超过10%,且一般项目(无标识项)中不符合要求的项目数不超过20%,检查结果为“限期整改”。
- 若关键项目中不符合要求的项目数超过10%,或者一般项目中不符合要求的项目数超过20%,检查结果为“未通过检查”。
2. 整改要求:
- 检查结果为“限期整改”的,企业需在检查结束后30个工作日内完成整改,并一次性提交整改报告给原检查部门。经复查合格后,药品监督管理部门将作出准予许可的书面决定。
- 若企业在30个工作日内未能提交整改报告,或者经复查后仍有不符合要求的项目,药品监督管理部门将作出不予许可的书面决定。
- 检查结果为“未通过检查”的,药品监督管理部门可以直接作出不予许可的书面决定。
3. 计算方法:
- 关键项目中不符合要求的项目数比例计算公式为:关键项目中不符合要求的项目数比例 = (关键项目中不符合要求的项目数 ÷ (关键项目总数 – 关键项目中确认的合理缺项项目数)) × 100%。
- 一般项目中不符合要求的项目数比例计算公式为:一般项目中不符合要求的项目数比例 = (一般项目中不符合要求的项目数 ÷ (一般项目总数 – 一般项目中确认的合理缺项项目数)) × 100%。
第三部分 其他监督检查
1.检查结果评定:
- 对于医疗器械经营企业的日常监督检查和经营备案后的现场检查,若企业适用的所有项目均符合要求或者能够在检查过程中立即整改完成的,检查结果为“通过检查”。
- 若存在不符合要求的项目且不能当场整改完成的,检查结果为“限期整改”。
-
检查中发现企业违反《医疗器械监督管理条例》《医疗器械经营监督管理办法》等相关规定的,应当依法依规进行处置。 -
若经评估认为不符合项目可能影响产品安全或有效性,将依据《医疗器械监督管理条例》第八十六条、《医疗器械经营监督管理办法》第二十二条、第二十四条等规定采取相应措施。
第四部分 实施日期
本《指导原则》自发布之日起正式实施。原食品药品监管总局印发的《医疗器械经营质量管理规范现场检查指导原则》(食药监械监〔2015〕239号)同时废止。
第五部分 指导原则内容
这里主要介绍※的内容,其他内容在微信公众号内回复 现场检查 即可获得医疗器械经营质量管理规范及其现场检查指导原则。

第六部分 现场检查主要查哪些内容
第一章 质量管理体系建立与改进
- 许可检查: 查看经营范围、经营方式、管理体系文件、组织机构、人员配置、设施设备。
- 监督检查: 查看许可证/备案信息、管理体系文件、组织机构、人员配置、设施设备。
- 人员履职: 通过谈话、文件/记录了解质量安全关键岗位人员对职责的熟悉程度和履职情况。
- 自查制度: 查看自查制度、自查报告、自查报告内容。
- 持续改进: 查看管理体系文件建立及更新情况、持续改进措施。
- 质量安全关键岗位: 查看岗位说明或岗位职责,核实人员配置。
- 企业负责人: 查看岗位职责,核实履职情况。
- 质量负责人: 查看岗位职责,核实履职情况。
- 质量管理人员: 查看岗位职责,核实履职情况。
- 制度: 查看购货者资格审核制度、销售记录制度、冷链医疗器械管理制度、直调管理制度等。
第三章 人员与培训
- 资质: 通过询问、调查、学历/职称证明等方式了解人员资质。
- 培训: 查看培训制度、培训记录、培训内容、考核记录、健康档案。
- 考核: 查看考核记录,确认是否进行上岗和定期考核。
- 经营场所与库房: 查看地址、面积、设施设备、环境、安全防护措施。
- 库房分区管理: 查看分区设置、色标管理、分区合理性。
- 设施设备: 查看隔离设施、通风防潮防虫鼠设施、照明设备、包装物料存放场所、特殊设备。
- 温湿度控制: 查看库区/库位设置、温湿度监测设备、温湿度设置范围。
- 计算机信息系统: 查看系统功能、权限管理、数据管理、信息交互、数据备份。
- 验证与校准: 查看设施设备验证/校准、计量器具校准/检定。

导图可微信公众号内回复 检查导图 获得。
第五章 采购、收货与验收
- 资质审核: 查看资质审核制度、供货者档案、产品档案、现场核查记录、报告记录。
- 采购记录: 查看采购合同/协议、采购订单、采购记录。
- 直调管理: 查看直调管理制度、直调产品记录、资质审核记录、记录传递证明。
- 收货管理: 查看收货记录、随货同行单、运输方式、待验区设置、冷链产品处理。
- 验收管理: 查看验收记录、进货查验记录、验收结论、不合格产品处置记录。
- 入库记录: 查看入库记录、记录内容。
- 贮存管理: 查看贮存条件、操作规范、分区设置、设备状态、非作业人员管理、非相关物品管理。
- 在库检查: 查看检查记录、记录内容、质量疑问产品处理记录。
- 效期管理: 查看效期管理制度、效期跟踪控制、过期产品处置。
- 盘点: 查看盘点记录、记录内容、账货相符、问题处理记录。
-
销售人员管理: 查看培训档案、授权书、培训内容。 - 销售记录: 查看销售记录、记录内容。
- 出库复核: 查看出库复核记录、复核结论、不合格产品处置。
- 运输管理: 查看运输记录、运输方式、运输工具、运输路线、防护措施。
- 冷链运输: 查看冷链运输工具验证控制文件、冷链运输记录、温度控制要求、冷藏车/箱/柜、校准报告/验证报告/操作规程。
- 委托运输: 查看委托运输质量保证协议、考核评估记录。
- 应急预案: 查看应急预案、演练记录。
- 售后服务制度: 查看制度、岗位职责、人员配置。
- 技术服务: 查看部门设置、人员配置、办公条件。
- 投诉处理: 查看管理规定、人员配置、投诉记录、处理记录。
- 退货管理: 查看管理制度、退货记录、验收记录、不合格产品处置。
- 不良事件监测: 查看人员配置、报告记录、配合调查。
- 召回管理: 查看管理制度、召回记录。