2024-03-06 专栏:
XI区 来源:XI区 分类:医学影像
评论(0)
新型光子计数探测器CT(PCD-CT)有可能解决以往CT系统的局限性,如空间分辨率不足、检测低对比度小结构的准确性有限或缺少常规可用的光谱信息(参见XI区:什么是光子计数CT?光子计数CT技术研究进展)。本文我们将解释PCD-CT的基本原理和潜在临床优势,重点介绍商用PCD-CT应用以来的最新文献。
计算机断层扫描(CT)自20世纪70年代诞生以来,经历了不断的技术发展;如今,它已成为一种成熟的影像学成像方法,凭借其速度和对解剖结构的精确呈现,成为影像诊断的重要支柱。在发展过程中,CT的应用范围逐渐从单纯的形态学成像技术扩展到包括组织灌注等各种功能参数。
然而,CT的某些技术局限性阻碍了其应用范围的进一步扩展。对于一些要求较高的任务,如对严重钙化和支架患者进行冠状动脉CT血管造影(cCTA),空间分辨率仍不理想。最近的一项研究表明,cCTA在诊断支架内再狭窄方面的性能仍然不足。在检测小的、低对比度结构方面的准确性有限,因此可能会漏诊或误诊癌症。最近的一项荟萃分析研究显示,22.5%的肝细胞癌在CT中被漏诊。此外,CT检查结果有时会模棱两可,如高密度肾囊肿,因此必须进行其他检查才能获得明确诊断并确定进一步的临床治疗方案。进一步降低CT的辐射剂量仍然是一个理想的目标。尽管技术不断进步,CT的辐射剂量仍占所有诊断和介入手术的一半以上。
最近引入临床实践的新型光子计数探测器CT(PCD-CT)有可能解决这些局限性,克服以往CT的弱点。
在介绍PCD-CT的基础知识之前,我们将简要概述这种新型探测器技术的发展历程。
第一台PCD-CT临床前原型(通用电气医疗保健公司)于2008年研制成功。对人体志愿者进行的几项研究证明了这种新检测原理的临床适用性。该CT系统使用32排碲化镉(CdTe)探测器,探测器像素为1×1mm2,有两个能量阈值。该系统只能以低于临床需要的辐射剂量运行。
从2014年开始,在临床研究环境中安装了3台混合双源PCD-CT临床前原型(SOMATOM CounT;西门子医疗)。这些原型机以临床双源CT(SOMATOM Definition Flash;西门子医疗)为基础,将2个探测器阵列中较小的一个替换为碲化镉PCD,其等中心Z轴覆盖范围为16 mm。子像素可通过各种方式组合成更大的像素,或以棋盘式排列读出4个能量阈值,并交替设置低能量和高能量阈值。该原型机首次实现了典型临床参数的扫描,如0.5 s的旋转时间和高达550 mA的管电流。PCD-CT与成熟的临床CT相比并不逊色。
2017年,在临床研究环境中安装了带有碲锌镉(CZT)探测器的单源PCD-CT原型(飞利浦医疗)。它的像素尺寸为0.5×0.5 mm2,有5个能量阈值。最短的机架旋转时间为1 s。该系统后来升级为临床前PCD-CT,其视场(FOV)为50cm,等中心的Z轴覆盖范围为17.6mm,机架旋转时间为0.33 s。
2020年,带有碲化镉探测器的第二代临床前PCD-CT(SOMATOM CounT Plus;西门子医疗)在3家临床机构安装。单源CT的机架旋转时间为0.3 s,配备的探测器由0.275×0.322 mm2(等中心为0.151×0.176 mm2)的子像素组成。该系统提供50 cm的FOV,等中心的Z轴覆盖范围为57.6 mm。
2021年,第一代PCD双源CT(PCD-DSCT)与2个碲化镉探测器(NAEOTOM Alpha,西门子医疗)实现了商业化。两个探测器的子像素尺寸均为0.275 × 0.322 mm2(等中心为0.151 × 0.176 mm2)。2×2子像素可合并为1个宏像素;然后,系统可通过144×0.4 mm准直度和两个探测器的4个能量阈值(合并为常规应用中的2个能量阈值)进行数据采集。子像素也可以单独读出。此外,还可利用宏像素的空间分辨率重建来自2个能量阈值的多能量图像。CT系统配备了2个X射线管,每个120 kW,有多个焦点,最小的焦点大小为0.4×0.4 mm2(等中心为0.181×0.181mm2)。同时,PCD-DSCT的技术性能也得到了评估。在本文的临床实例中,我们将主要参考该临床系统。
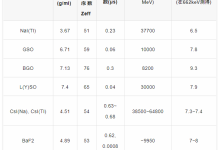
光子计数探测器由碲镉(CdTe)、碲锌镉(CZT)或硅(Si)等半导体制成。由于原子序数较高,碲化镉和碲锌镉层可以相对较薄(1.4-2mm),但仍能提供较高的X射线吸收率。而由硅制成的光子计数探测器则需要更厚(30-60mm)才能充分吸收X射线。根据目前的文献,所有临床前或临床使用的PCD-CT都配备了碲化镉或碲锌镉探测器。图1显示了基于碲化镉或碲锌镉的PCD的结构示意图。在半导体层的上侧是一个大面积的阴极电极,在下侧为像素化阳极电极。在阴极和单个阳极之间施加800-1000 V的高压,可产生强大的电场。入射的X射线被半导体吸收,产生的电荷(电子-空穴对)在电场中分离。电子移动到阳极,在那里产生持续时间约为1 ns(109 s)的短电流脉冲,通过电子脉冲整形电路转换成半宽(FWHM)为10-15 ns的电压脉冲。电压脉冲的脉冲高度与X射线的吸收能量E成正比。一旦脉冲超过阈值TL,即吸收能量(通常为20-25 keV),读出电子装置就会对其进行计数。在技术实现中,使用了一个脉冲高度比较器电路,其中输入了与阈值能量相对应的电压,参见图1。探测器信号相当于在投影测量时间内记录的所有脉冲的总和。
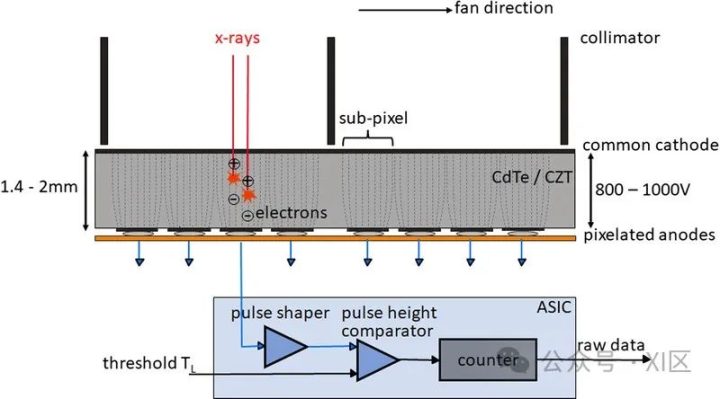
图1 CdTe/CZT PCD(上图)和相应读出ASIC(下图)的示意图。从CT系统的正面看,扇形方向是沿探测器扇形扫描平面的方向。单个探测器像素是由公共阴极和像素化阳极(此处用虚线表示)之间的强电场形成的;像素之间无需进一步分离。在本图所示的探测器结构中,两个准直器叶片之间各有4个子像素,用于抑制散射辐射,另见图4。在ASIC中,被吸收的X射线量子产生的电压脉冲在脉冲高度比较器中与对应于所需阈值能量(20-25 keV)的阈值电压进行比较。只有超过该阈值能量的X射线量子才会被计数。
为了获得光谱分辨数据,需要同时读出在不同阈值能量下工作的多个计数器,见图2。然后,探测器为每个阈值提供单独的数据流,其中只包含能量超过相应阈值能量的X射线量子,另见图2。从包含能量超过最低阈值能量TL的所有X射线量子的数据流中重建的图像(TL图像,西门子公司专有,也称为T3D图像)可与传统CT在相同的X射线管电压(kVp)下获得的图像相媲美。然而,在现实的PCD中,由于不可避免的物理效应降低了信号的光谱分离度,如像素边界的电荷共享或荧光导致的X射线量子能量损失,能量登记存在误差。这些效应的示意图如图3所示,它们会导致量子在X射线能量过低时被错误地计数两次。与CdTe-PCD或CZT-PCD相比,硅PCD受电荷共享和荧光的影响较小,因此光谱分离效果较好,但大多数X射线量子主要在硅晶体中散射,而不是直接吸收;它们经常离开探测器像素而不产生信号,因此探测器的探测量子效率降低,所有探测任务都需要更高的辐射剂量。在非常高的X射线通量下,产生的电压脉冲在时间上重叠,不再单独计数。然而,在实际的CT通量率下,脉冲堆积并不起作用。
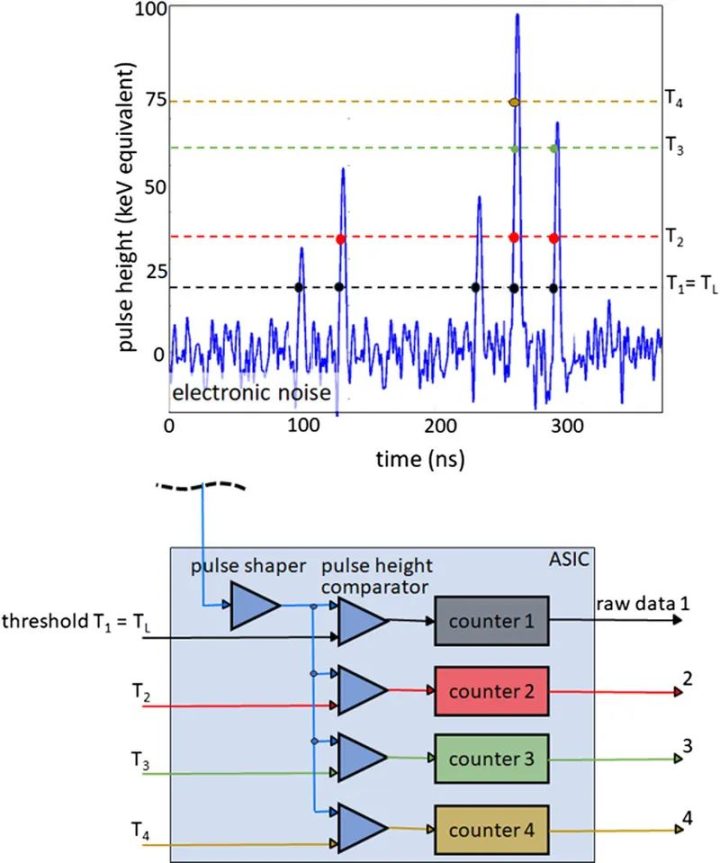
图2 使用PCD采集光谱数据的示意图。上图所示为吸收不同能量的X射线量子所产生的电压脉冲时间序列。下图是一个4门限计数器的技术实现示意图。在此示例中,同时读出4个计数器的阈值能量分别为20、35、60和75 keV。探测器提供4个原始数据流,其中只包含吸收能量大于各自阈值能量的计数X射线量子。
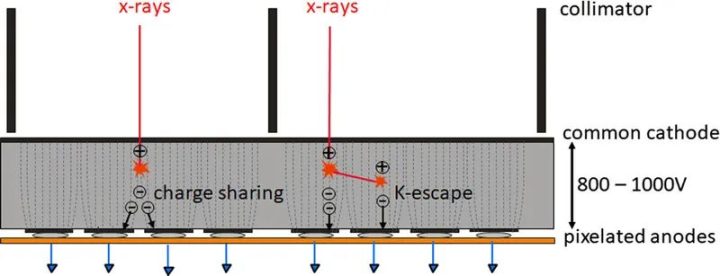
图3 电荷共享和K-escape的示意图,它们降低了现实PCD的能量分离。靠近像素边界吸收的X射线会产生电子,这些电子会在相邻像素中产生信号(电荷共享)。因此,一个X射线光子会以过低的能量被错误地计数多次。入射的X射线最初还会击穿探测器材料的内壳电子(K电子)。这会产生荧光辐射,荧光辐射会被探测器单元本身或邻近的探测器单元重新吸收和计数(K-逃逸)。入射到初级相互作用位点的X射线以过低的能量进行计数。
通过其探测原理,PCD有可能克服传统能量积分闪烁探测器(EID)的一些局限性,迄今为止,几乎所有CT设备都使用了这种探测器。
与任何电子设备一样,探测器的读出电子元件会产生一定量的背景噪声。在PCD中,X射线量子计数必须超过的最低阈值能量约为20 keV;在X射线管的主光束中没有低于此能量的X射线,因为它们已被预滤波器滤除。这一阈值能量远高于电子设备的本底噪声,因此电子噪声不会影响PCD的计数率,见图2。因此,即使在低X射线通量下,信号也只显示X射线光子的统计量子噪声。而在传统的EID中,电子噪声在低X射线通量时会主导信号,因此图像噪声会急剧增加,出现噪声条纹,CT值的稳定性也会受到影响。光子计数探测器在检查肥胖病人和进行低剂量扫描时能提供更好、更低噪声的图像,从而为进一步降低辐射剂量提供了可能。早期的临床前原型在模型扫描和对志愿者的初步研究中就注意到,PCD在低辐射剂量下具有卓越的图像质量。研究的重点是低剂量的肺部成像,这在肺癌筛查等方面非常重要。最近,研究人员评估了PCD-CT在评估系统性硬化症患者间质性肺病(ILD)时减少辐射剂量的潜力。一项对80名患者进行的研究显示,PCD-CT的平均CTDIvol为0.72 mGy,其图像噪声、主观图像质量和诊断准确性与2.3 mGy的DSCT相当。作者总结说,使用PCD-CT评估ILD可以减少66%的辐射剂量,而不会影响诊断准确性。对儿童患者(平均年龄2.6岁)进行的超低辐射剂量(平均SSDE为0.45 mGy)光子计数探测器CT胸部检查显示,肺部结构的图像质量良好至极佳,软组织结构的图像质量中等。最近的一项研究对PCD-CT在检查严重肥胖患者方面的潜力进行了调查,51名超重患者(体重指数[BMI]中位数为32.15 kg/m2)在第二代DSCT和第一代PCD-DSCT上接受了有临床指征的腹部增强CT。作者观察到剂量明显减少(PCD-CT的平均CTDIvol为12.00 mGy,DSCT为16.05 mGy),同时图像质量保持相似甚至有所提高。PCD-CT在评估肥胖患者肿瘤方面的优势在其他地方也有描述。
光子计数探测器的结构比传统的EID更精细。在EID中,单个探测器像素必须由不透明的中间层隔开,以防止光学串扰。这些中间层的厚度约为0.1mm,会降低探测器的剂量效率,因为中间层吸收的X射线量子不会对探测器信号产生影响。探测器像素的结构越小,这些中间层的相对面积就越大,剂量效率就越低。因此,EID的探测器像素不可能比现在小很多。在内耳扫描等特殊应用中,提高空间分辨率的替代技术是通过可移动的梳状孔径减小探测器像素的有效面积,其缺点是由于探测器的剂量效率大大降低而导致辐射剂量显著增加(参见XI区:什么是CT高分辨力成像?)。
另一方面,光子计数探测器不需要在单个像素之间设置格栅(见图1)。探测器的像素可以比EID小得多,从而大大提高了空间分辨率。实现这一点的前提条件是X射线管的焦点相应较小,即使这是以降低X射线管功率为代价的。否则,焦点尺寸将限制空间分辨率。PCD-CT空间分辨率的提高已在临床前原型上得到成功验证。例如,混合双源PCD-CT扫描平面的空间分辨率为0.15 mm,层厚为0.41 mm。根据制造商的不同,临床前原型机的探测器像素大小在0.225×0.225 mm2和0.5×0.5 mm2之间;无论如何,它们都比EID-CT系统的探测器像素小得多。
图4显示了市售PCD-CT与第三代DSCT的探测器结构对比。探测器像素大小为0.275×0.322mm2(等中心为0.151×0.176mm2)。每组4×6探测器像素通过一个二维准直器网格与相邻组隔开,以减少散射辐射。使用这种探测器和0.4×0.4mm2的焦点,可以实现超过40 lp/cm的分辨率,相当于0.125mm,见图5;这大约是EID-CT系统分辨率的两倍。在CT中,空间分辨率的提高总是伴随着图像噪声的增加或辐射剂量的相应增加;CT的这一基本规律也适用于PCD-CT。因此,必须采用基于迭代或深度学习的精细降噪技术。
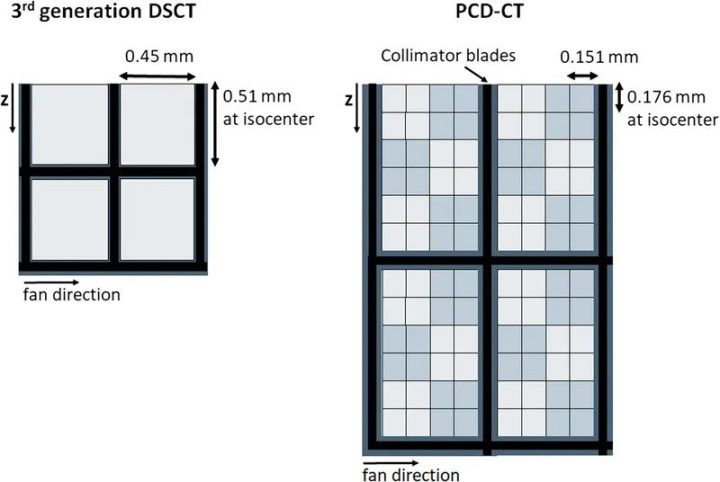
图4 带有闪烁体探测器(左)和商用PCD-DSCT(右)的第三代DSCT的探测器结构示意图。从上往下看,z方向是病人的纵向。粗黑线示意性地表示用于抑制散射辐射的准直器网格。在超高分辨率模式下,PCD的探测器像素单独读出。在标准扫描模式下,2×2像素合并为一个宏像素–用浅灰色和深灰色方格表示。
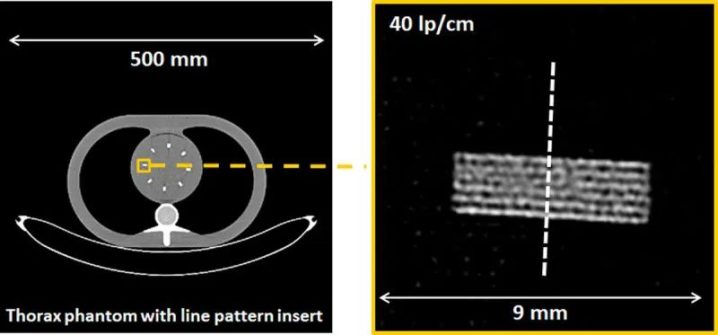
图5 在PCD-CT上实现40lp/cm空间分辨率的演示,探测器示意图如图4所示。在重建过程中,使用了最锐利卷积核Br98。
在临床上,出色的空间分辨率对于评估小型骨性结构(如内耳或腕部结构)至关重要。在肺部检查(尤其是用于ILD的鉴别诊断)和小血管CT血管造影(如头颈部和四肢)方面也有优势。在cCTA中,以前由于严重钙化而导致高估血管狭窄的局限性可能会被克服。临床前原型已经证明了cCTA在上述临床领域的优势。
最近,在一项对5具尸体头部的研究表明,与EID-CT相比,PCD-CT在颞骨的超高分辨率(UHR)检查中提供了优越的图像质量和显著的剂量节省(平均剂量减少79.3%)。在13名患者的颞骨检查中,PCD-CT在评估所有个体解剖结构时被评为优于EID-CT,平均辐射剂量比EID-CT低31%。图6显示了一个临床案例,说明PCD-CT在内耳成像中的潜力。在使用小鼠作为样本对PCD-CT和EID-CT之间的最小骨骼细节的可视化进行比较时,发现在剂量匹配扫描中,PCD-CT比EID-CT提供了明显更小的图像噪声、更高的信噪比和更高的边缘清晰度。在骨小梁成像中,PCD-CT的有效容积空间分辨率(定义为每mm3可单独表示的元素数量)比传统CT高5倍以上。
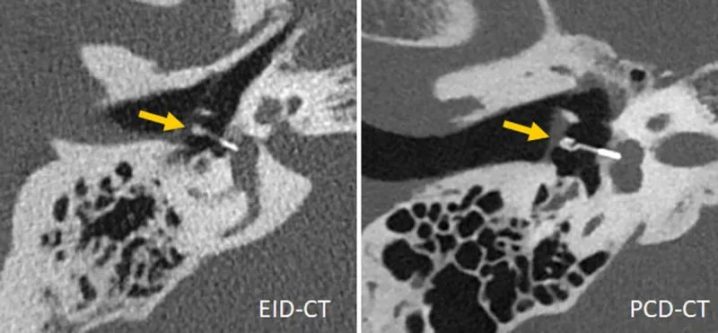
图6 用第三代DSCT(左)和第一代PCD-DSCT采集的内耳扫描(右),显示PCD-CT对钛K活塞镫骨假体(箭头,远端直径0.4mm)的可视化效果更佳。
在高分辨率肺部成像中,与EID-CT相比,PCD-CT可提供更好的图像质量,而辐射剂量却明显更低。在一项针对30名因怀疑患有ILD而接受传统EID-CT和PCD-CT检查的患者的研究中,UHR PCD-CT在辐射剂量略低的情况下显示出明显更好的整体图像质量和清晰度。此外,UHR PCD-CT还提高了读者对是否存在网状结构、磨玻璃不透明和马赛克模式等成像结果的可信度,对是否存在通常的间质性肺炎的可信度也有了特异性的提高,参见图7中的示例。一项比较PCD-CT和EID-CT的模型研究证实,高分辨率PCD-CT能以较低的辐射剂量更准确地量化肺结节体积和气道壁厚度。
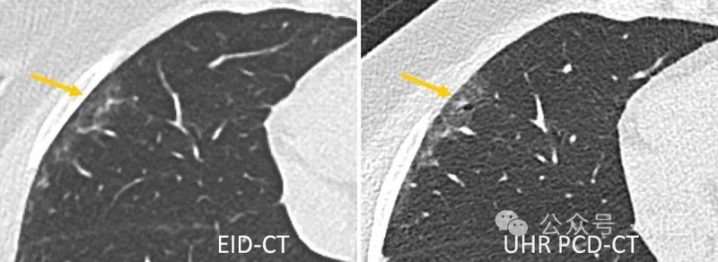
图7 通过第三代DSCT(左)和第一代PCD-DSCT(右)获得的间质性肺病患者的肺部扫描图。UHR PCD-CT扫描证实右肺中叶外围存在牵引性支气管扩张(箭头),并与轻度磨玻璃衰减相叠加。这一发现在EID-CT扫描中被忽略。
冠状动脉CTA是另一种受益于空间分辨率提高的应用。尽管技术不断进步,但某些患者群体仍有获得非诊断性图像质量的高风险;严重的冠状动脉钙化代表了非诊断性检查的最大风险。PCD-CT的高分辨率有可能解决目前cCTA的局限性,尤其是在存在强钙化的情况下高估狭窄的问题。在一项运动模型研究中,与标准分辨率CT相比,UHR PCD-DSCT提高了血管狭窄量化的准确性,减少了钙化伪影,且不受心率的影响。在一项有14人参加的使用双层EID-CT和原型PCD-CT进行cCTA的研究中,在100%、92%和45%的冠状动脉钙化、支架和非钙化斑块病例中,PCD-CT图像的总体图像质量和诊断可信度得分更高。在一项对20名使用PCD-DSCT的患者进行的研究中,层厚为0.2 mm的UHR cCTA和使用锐利卷积核(Bv64或Bv72)进行的图像重建对斑块和周围血管腔提供了极好的解剖可视性,且不会出现明显的开花伪影。在定量评估中,开花伪影从使用标准卷积核(Bv40)时的52.8%下降到使用Bv72时的39.7%。在20名患者的22个斑块中,与参考标准相比,层厚为0.2mm、采用Bv64卷积核重建的斑块总体积和钙化成分体积分别平均减少了23%和32%。纤维成分的体积保持相似,而脂质成分的体积则显著增加。在一名68岁胸痛患者的冠状动脉CTA中,UHR PCD-DSCT可以观察到微钙化和纤维帽,光学相干断层扫描也证实了这一点。

图8 通过UHR PCD-CT改善冠状动脉斑块特征描述的临床示例。在标准重建(左图)中的钙化斑块,在UHR图像(右图)中变成了部分钙化斑块,体积也变小了。
在EID中,被吸收的低能量X射线量子产生的光量少于高能量的量子,因此它们对探测器信号的贡献较小。EID产生的信号与投影测量时间内记录的总X射线能量相对应。而光子计数探测器则对能量超过最低能量阈值的所有X射线量子进行等权重计数。低能量X射线量子对探测器信号的贡献与高能量X射线不相上下。大部分低对比度信息都包含在低X射线能量范围内,因此在PCD-CT中,低对比度差异往往更加明显。使用碘造影剂进行CT扫描时尤其如此。碘在33keV处有一个K-edge;它在K-edge上方的低能区吸收最强。因此,在PCD-CT图像中,碘对比度要高于在相同X射线管电压(kVp)下获得的EID-CT图像。在相同的辐射剂量下,较高的碘信号会导致较高的碘对比噪声比(CNR)。在一项使用4个不同大小的拟人化模型对临床前PCD-CT原型进行的研究中,观察到在80、100、120和140 kVp下,碘对比噪声比(CNR)的平均增幅分别为11%、23%、31%和38%。
在临床上,碘CNR的增加意味着增强扫描的图像质量更好,或可能减少辐射或造影剂剂量。在一项早期的模型研究中,由于碘CNR增加,剂量减少了32%。在一项由70名肿瘤患者组成的队列中,他们首先在第二代DSCT上接受常规造影剂增强腹部和盆腔CT扫描,然后在PCD-CT上进行随访,结果发现PCD-CT的TL图像与DSCT相比,图像质量相似甚至更好(肝脏病变更清晰),平均辐射剂量减少32%(平均CTDIvol/DLP = 7.98 mGy/393.1 mGy·cm,DSCT为14.11 mGy/693.6 mGy·cm)。作者将这一结果归因于低能量X射线量子的权重提高,从而提高了碘对比度,而电子噪声的缺失和迭代重建的改进也为这一结果提供了帮助。在一项针对100名胸部肿瘤患者的类似研究中,与第二代DSCT相比,在保持图像质量的情况下,平均辐射剂量减少了40%以上(PCD-CT的平均CTDIvol/DLP = 4.17 mGy/151.0 mGy·cm,DSCT的平均CTDIvol/DLP = 7.21 mGy/288.6 mGy·cm)。
在多阈值模式下,PCD可同时提供多个探测器信号,其中只包含能量大于相应能量阈值的X射线量子,见图1。有了两个能量阈值,目前所有已建立的双能量应用都成为可能,这些应用都是基于将材料分解成两种基本材料(如碘和水)。因此,虚拟单色图像(VMI)、碘图或虚拟平扫(VNC)图像可以在任何可能与这些结果相关的患者检查中进行常规计算。虚拟平扫是将材料分解成碘和软组织部分后的软组织图像的另一个术语。虚拟单色图像基于相同的材料分解。不过,这里的基础材料图像是按比例缩放的,因此碘和软组织的衰减与使用所需能量(以keV计)的单能X射线获取并重新组合为VMI的图像完全相同。而对于其他材料,例如钙,则无法正确再现所需的keV衰减。
第一代临床PCD-CT采用了一种方法,为所有常规造影剂增强检查提供120 kVp或140 kVp的标准化采集协议。每次CT扫描的主要图像输出是根据临床问题量身定制的KeV水平的VMI,例如,用于实质器官成像的是60-65 keV,或用于CT血管造影的是45-55 keV。VMI的碘CNR可通过改进算法得到改善,使其随着keV的降低而增加,就像用较低的管电压(kVp)采集图像一样,见图9。这种方法能更好地实现CT图像结果的标准化,因为VMI中的碘对比度只取决于所选的keV水平,而与采集条件(尤其是X射线管电压)无关。
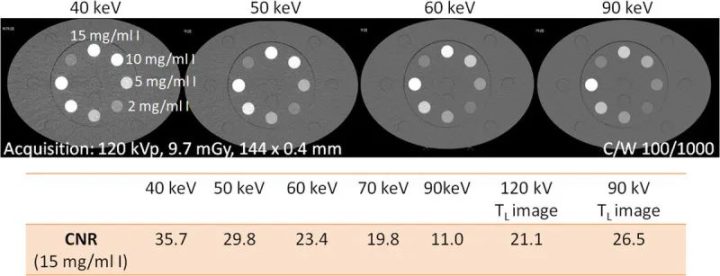
图9 将装有15mgI/ml溶液的管子插入大型(40×30cm)Gammex多能CT体模(Sun Nuclear Corporation)中,用PCD-DSCT扫描时的CNR。随着VMI的KeV水平降低,碘CNR也随之增加。120 kV扫描(插值)的55 keV VMI中的碘CNR相当于90 kV扫描(90kV的TL图像),而55 keV VMI中的碘CNR相当于120 kV扫描。
有几项临床研究对PCD-CT的VMI图像质量、CNR以及与EID-CT相比对患者造成的相关辐射剂量进行了调查。一组50名患有肝转移的肿瘤患者使用PCD-CT在120 kV电压下进行扫描,另一组50名患者使用EID-CT在自动选择管电压的情况下进行扫描,其中大部分扫描建议使用100 kV电压。与EID-CT的多色图像相比,PCD-CT的VMI在70 keV时显示出更低的图像噪点,在辐射剂量相似的情况下,40-70 keV范围内的CNR始终更高(PCD-CT的CTDIvol为6.7 mGy,EID-CT为6.4 mGy)。此外,在低keV下,低血管化肝转移灶的清晰度明显更高,与低体重指数患者相比,高体重指数患者可从PCD-CT中获益,因为图像噪声和病灶清晰度都得到了保留。在另一项研究中,40名患者在第三代DSCT的高螺距模式下接受了胸腹主动脉CTA。通过自动选择管电压(参考电压100kV)来选择最佳管电压。每位患者都在管电压为120 kV的PCD-CT上接受了辐射剂量匹配的后续扫描,并在40、45、50和55 keV下重建了VMI。与EID-CT图像相比,40和45 keV PCD-CT的平均CNR明显更高,超重患者的CNR增益更高。在主观图像分析中,考虑到40和45 keV的图像噪声增加,45至50 keV的VMI被认为是最佳折衷。在其他研究中也观察到碘CNR在极低keV(如40 keV)时最高,但由于40 keV时图像噪声较高,诊断时首选稍高的keV(如50 keV)的趋势。在一项对39名门静脉期接受增强腹部PCD-CT的患者进行的比较研究中,作者发现在50 keV下对VMI进行标准化重建的效果最佳,与EID-CT相比,在相同辐射剂量下,主观图像质量相似,CNR明显更高。图10显示了腹部CT扫描的临床实例。在对80名疑似肺栓塞(PE)患者进行的PCD-CT检查中,50 keV的VMI的主观PE可见度最高。对于冠状动脉CTA,在模型评估和对10名患者的研究中,如果结合高水平的迭代重建(QIR3和QIR4),40 keV的VMI更受青睐。
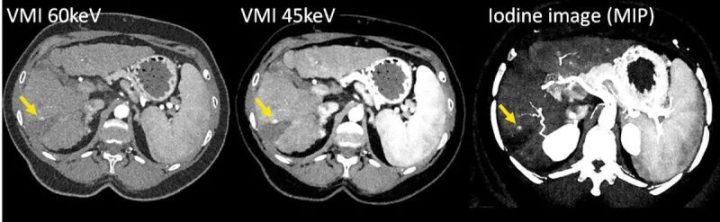
图10 用PCD-DSCT(120 kV、144×0.4 mm、CTDIvol = 4.8 mGy)扫描的肝硬化和消融后肿瘤复发患者的CT图像。随着VMI(左侧和中间)的KeV水平降低,碘CNR增加,肿瘤复发(箭头)变得更加明显。碘图像(右)可以量化碘吸收。
同时,还研究了在低能量下使用VMI时减少造影剂的可能性。在PCD-CT的动态循环模型中,即使造影剂浓度降低50%,冠状动脉CTA中以40keV重建的VMI也能达到诊断上足够的碘CNR。在一组60名患者中,造影剂用量减少25%(从三相方案中370 mgI/ml造影剂的70 ml减少到相同造影剂的52.5 ml)的方案显示,在相同辐射剂量下,与EID-CT相比,PCD-CT的主动脉CTA质量并不逊色,此时50 keV的VMI是客观和主观图像质量之间的最佳折中方案。
在不同能量下重建VMI的能力可提高诊断可信度。在使用50 keV的VMI与大螺距PCD-DSCT进行冠状动脉CTA时,低造影剂剂量方案(30ml的350mgI/ml造影剂而不是常规的60mL)在一组27名患者中产生了诊断图像质量。在评估与钙化斑块和支架相关的管腔狭窄时,增加100 keV VMI提高了诊断信心,并通过减少开花伪影降低了9名患者的CAD-RADS评分。
虚拟单色图像也可用于无造影剂的CT扫描,在这种情况下,必须特别注意选择用于钙化评分等定量应用的keV水平。通过选择适当的KeV组合和迭代重建强度(量子迭代重建QIR,西门子医疗),EID-CT的钙化评分结果可以在PCD-CT上重现。在一项结合模型和患者的研究中,作者使用70 keV和QIR 0或65 keV和QIR3或QIR 4的VMI对120 kV PCD-DSCT扫描进行了精确的冠状动脉钙化评分。在90 kV电压下使用65 keV和QIR 3以及在Sn100 kV电压下使用70 keV和QIR 1进行图像重建,可获得与EID-CT相媲美的钙化评分结果,并有可能大幅减少辐射剂量。
虚拟平扫图像具有临床意义,因为如果图像质量足够高,就无需进行CT平扫,从而减少了患者的总辐射剂量。有几项研究对PCD-CT的VNC图像质量进行了调查,其中一些有争议的结果可能是早期软件和扫描仪版本造成的。在一个拟人化腹部模型的VNC图像中观察到平均绝对误差为4.1 HU,该模型带有碘化肝脏插入物(1.4 mgI/ml)和19个肝脏病灶(碘含量为0-5 mg/ml)。这一模型结果在15例肝脏低密度病变患者中得到证实,与TNC图像相比,VNC图像的平均误差为3.7 HU。在一组100名患者中,PCD-CT动脉和门静脉相的腹部VNC图像与TNC图像相比,CT衰减准确,图像质量良好,76%的测量误差小于5 HU,95%的测量误差小于10 HU。VNC图像的主观图像质量评分较低;但99%-100%的患者都能达到诊断质量。其他研究倾向于显示VNC和TNC之间存在较大差异,PCD-CT的VNC图像导致肾上腺腺瘤真实平扫衰减的高估和低估。在研究可能的临床应用时,发现PCD-CT的VNC图像在评估肝脏脂肪变性和增强肺扫描的肺气肿定量方面可靠。
高时间和空间分辨率与光谱数据采集相结合,为心血管CT带来了新的应用。例如,将材料分解为碘和钙可用于去除cCTA中的碘,只留下冠状动脉中的钙(PURE Calcium,西门子医疗)。与分解为碘和软组织(VNC图像)的普通材料不同,钙在两种基础材料图像之间分裂,因此在VNC图像中的密度降低,而这种特殊材料分解的目的是保留PURE Calcium图像中的钙密度,使其有可能用于钙评分。一项对67名患者进行的研究表明,TNC图像与钙化评分有很高的相关性,但仍低估了从纯钙图像得出的钙化评分。相比之下,VNC图像得出的钙化评分被低估的程度要大得多。
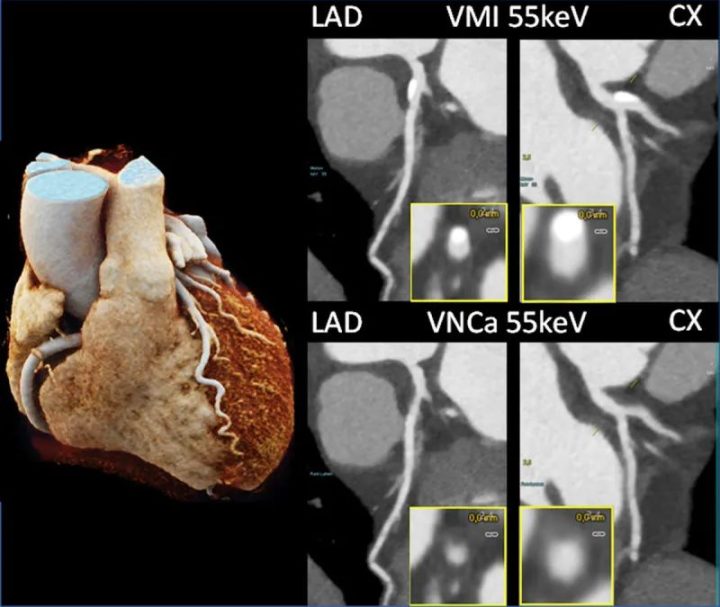
在一个相关的应用中,也是基于将物质分解为碘和钙,将钙化斑块从CTA成像的对比剂填充血管中去除,以提供虚拟非钙化图像(PURE Lumen,西门子医疗)。一项模型研究表明,在模拟心率高达每分钟80次的情况下,由严重钙化斑块引起的开花伪影减少,图像可解释性提高。因此,这种应用可以更好地评估血管管腔;不过,其功效还有待临床研究证实。图11显示了一个临床实例。
图11 用PCD-DSCT扫描的LAD和CX有钙化的患者的冠状动脉CTA图像(120 kV、144×0.4 mm、0.25 s旋转时间、66 ms时间分辨率)。55 keV虚拟单色成像(上)中显示的钙化在55 keV虚拟非钙化成像(下)中被去除。
如果采用2个以上的能量阈值,如图2中的4个,原则上可以分离出2种以上的基底材料。例如,可以像以前一样选择碘和水作为基础材料,然后从这两种材料中分离出第三种材料。不过,这只有在第三种材料的K-edge处于40至100 keV之间的相关CT能量范围时才可行。遗憾的是,人体中天然存在的所有元素都不具有这个范围内的K-edge,因为它们的原子序数太低。因此,必须将钆、金、铪或钨等原子序数较高的元素作为造影剂引入人体,以实现多物质分解。此类应用是临床前研究的主题。
要将PCD-CT广泛应用于临床,仅展示其技术能力是不够的。相反,必须证明PCD-CT对诊断准确性和诊断信心有积极影响,最好还能改变患者的临床治疗。初步研究已经表明,在不同的临床领域,这些技术对诊断性能和诊断准确性都有影响,而更大规模、更全面的临床研究也必将随之而来。
此外,我们可能会看到,通过基于放射组学和深度学习等的精细图像分析,高分辨率PCD-CT数据中的大量信息将得到更好的利用。这方面的初步研究已经启动。例如,由于PCD-CT具有更好的空间分辨率和信噪比,因此可以检测主动脉周围脂肪组织的纹理变化是否与局部主动脉钙化有关,从而为动脉粥样硬化的发展提供生物标记。对腹部VMI和心肌中放射组学特征的稳定性进行了研究,结果表明左心室心肌的某些纹理改变可能与Agatston评分估计的冠状动脉钙化严重程度有关。
编译整理自:Flohr T, Schmidt B. Technical Basics and Clinical Benefits of Photon-Counting CT. Invest Radiol. 2023 Jul 1;58(7):441-450. doi: 10.1097/RLI.0000000000000980. 仅供专业人士交流目的,不用于商业用途。
版权声明:本文采用知识共享 署名4.0国际许可协议 [BY-NC-SA] 进行授权
文章名称:《光子计数CT之发展简史,物理原理与临床优势》
文章链接:
https://www.qixiezhixin.com/8007.html
本站所有非原创内容均来自转载或分享,仅供学习交流,不用于商业用途。如无意中侵犯了知识产权,请来信告知,将立即配合删除。Email:qixiezhongguo@qq.com