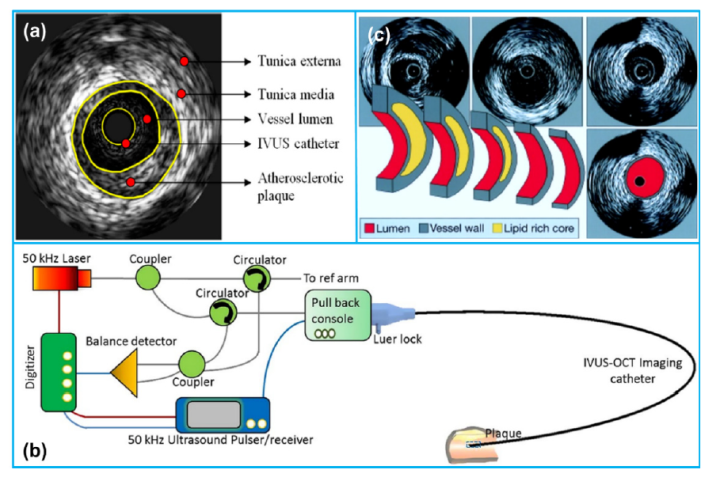
血管内超声(Intravascular ultrasound,IVUS)是一种血管内的成像方式,可用于各类介入学科,以表征病变形态、量化斑块负荷、指导器械尺寸选择、评估器械植入以及识别并发症。IVUS作为斑块诊断最常用的成像技术,可提供分辨率约为100微米,成像深度约为7毫米的血管横截面结构图像,但无法显示与斑块易损性相关的微观特征,譬如新生血管、巨噬细胞聚集和薄纤维帽等。
IVUS在经皮冠状动脉介入( percutaneous coronary intervention,PCI)手术中可起到重要的辅助决策作用,包括术前评估及术后优化。PCI术前,IVUS主要用于评估斑块性质和特点,制定合适的预处理策略,测量病变长度和参考段血管直径,选择合适的支架直径、长度及落脚点。PCI术后,IVUS主要用于明确支架的膨胀与贴壁情况以及有无支架边缘夹层等并发症,以有的放矢地达到PCI术后即刻结果的最优化,研究显示,达到IVUS下最优化手术结果的患者的临床预后显著优于未达到最优化结果的患者,后者的预后情况与仪接受选影指导PCI的患者相仿,无法体现IVUS的优越性。
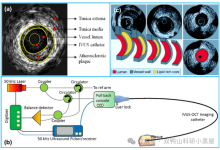
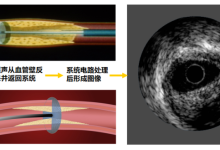
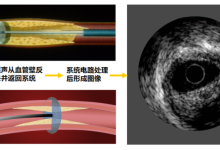
IVUS系统一般由三个部分组成:控制台(Console)、导管回撤系统(Automatic pullback device)和成像导管(Imaging catheter)。其成像原理与基于超声的其它成像方式相同,即导管头端换能器从控制台接受电信号,通过电刺激使得换能器中的压电晶体膨胀和收缩以产生高频超声波,随后这些超声波于组织界面处散射和反射,部分反射回的超声波由换能器再转换回电信号,最终由控制台中的成像引擎分析处理,转化为灰度横截面图像。
图1 典型的IVUS系统,及其成像的示意图(图片来源:网络)
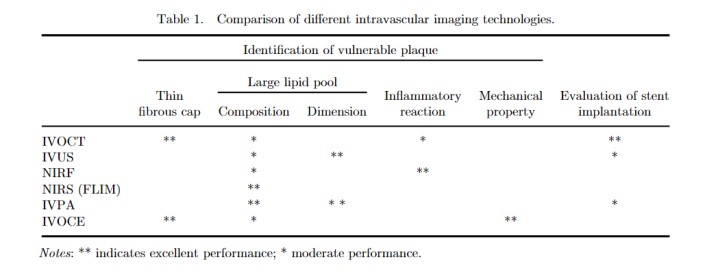
图2 不同血管内成像技术的比较。Intravascular optical coherence tomography,IVOCT,血管内光学相干断层扫描;Intravascular near-infrared fluorescence/spectroscopy,NIRF/NIRS,血管内近红外荧光成像;Intravascular photoacoustic,IVPA,血管内光声成像;Intravascular optical coherence elastography,IVOCE,血管内光学相干弹性成像(图片来源:网络)
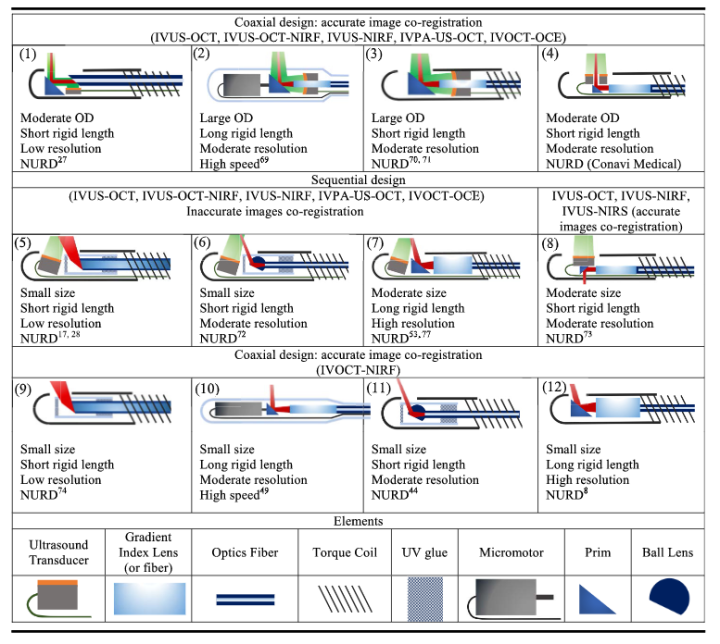
其中的IVUS导管,从诞生至目前,一般认为存在两种基本的设计:机械旋转型和电子相控阵型。
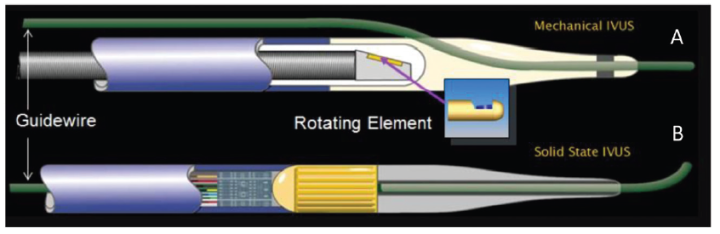
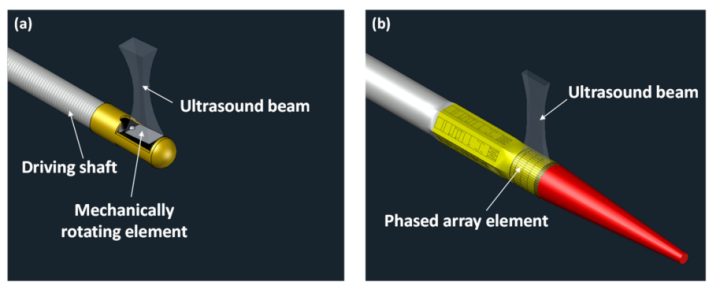
图4 IVUS成像导管的两种类型
A,机械旋转型;B,相控阵型(图片来源:网络)
图5 两种类型IVUS导管的原理和超声波束比较(图片来源:网络)
机械旋转型IVUS导管通过1800转以上的360°旋转获得图像,因此只需单个换能器组件,导管直径可达非常小(<2mm),较轻松地通过狭窄部位以获得血管图像。然而,由于其图像是于血管内的机械旋转中获得的,因此可能出现失真,尤其是在严重弯曲的血管区域成像时。此外,导管旋转可使其自身与鞘间产生小气泡,可能会干扰超声的发射与接受,术中一般需要盐水冲洗。与之相对应,相控阵型IVUS导管的横向波束较窄,具有良好的横向分辨率,且没有旋转运动引起的图像失真;但其头端设计存在一个较长的硬段(譬如7mm),且由于需设计控制每个组件的复杂系统,制造成本也较高。
图6 再看一遍两种IVUS导管。(a)机械旋转型(Visions PV.35;Philips);(b)相控阵型(AcuNav;Siemens)
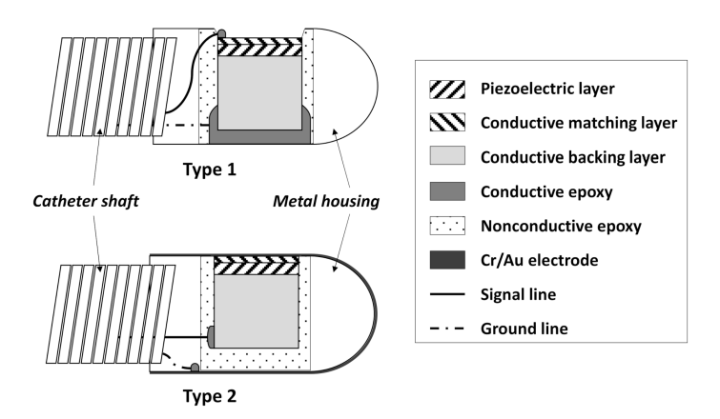
图7 两种机械旋转型IVUS导管的结构设计。通常来说,IVUS换能器需安装于导管轴上,并包含在2-4Fr直径的导管中,以便进入狭窄血管,因此换能器的尺寸限制为<1.2mm,这也意味着换能器的材料选择极为有限。背层(backing layer)一方面能降低压电层(Piezoelectric layer)振动,另一方面阻止从其表面反射信号(图片来源:网络)
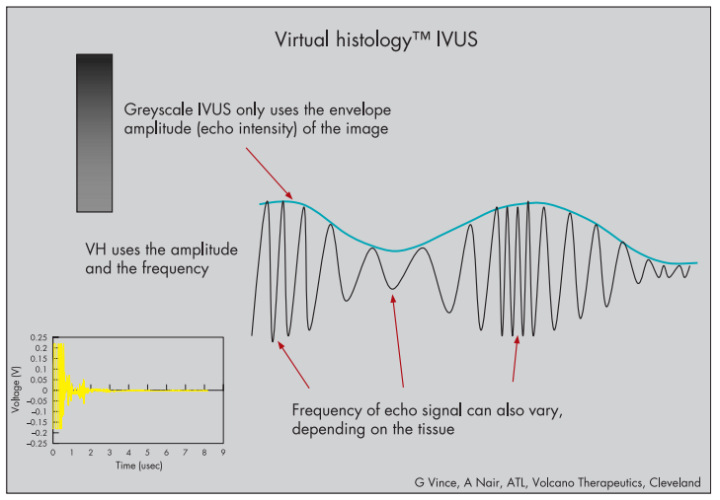
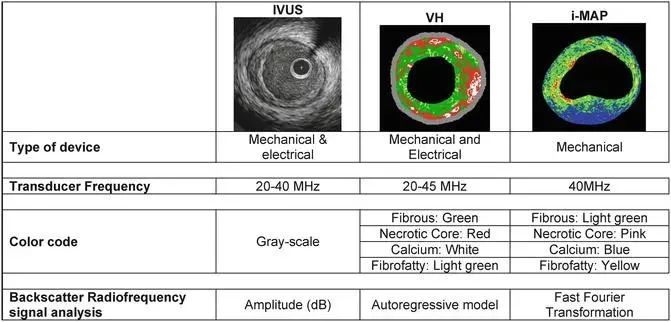
为了弥补传统超声成像对客观和定量评估斑块的局限性,目前有三种临床实践中的商用软件,一种是虚拟组织学成像IVUS(Virtual histology,VH-IVUS)(Volcano Corporation),通过分析回波中的频谱信号,识别不同组织的不同频率;第二种是集成反向散射(Integrated backscatter,IB)IVUS(IB-IBUS)(YD Co,Ltd);第三种则是基于射频(Radiofrequency,RF)信号识别模式的组织表征系统iMAP-IVUS(Boston Scientific)。这三种中,诞生最早也最常用的是VH-IVUS,由于算法来自于不同的厂家,是故各自图像中颜色代表的组织也不同,但都能帮助检测薄帽纤维粥样斑块(Thin-cap fibroatheroma,TCFA),并预测患者将来是否可能发生急性冠脉综合征。(既往曾认为只有相控阵型导管能够提供此类分析,目前机械旋转型导管亦可实现)。
超声导管接收到的射频RF信号可分为不同的“频率窗口”,将每一种信号通过复杂的算法进行处理,随后,将其与已知冠脉斑块的四种主要组织类型信号轮廓数据库进行匹配,最后决策树将颜色分配给相匹配的像素,并重建VH图像。
图9 普通与VH-、iMAP-IVUS的比较(图片来源:网络)
图10 同一冠脉部位,IB-和iMAP-IVUS获得的典型图像比较,其中(A)和(C)来自IB-IVUS,(B)和(D)来自iMAP-IVUS。EEM,external elastic membrane,外弹力膜;CSA,cross-sectional area,横截面积(图片来源:网络)
这里就体现了一个问题,不同IVUS导管的功率输出和信号接收灵敏度都存在差异,既往对边界自动化和组织表征进行标准化的努力也未成功,因此,不同导管和算法系统对同一病变的重建可能存在差异,虽然这个差异可能并不大,如上图10。
血管内超声源于腔内超声( intraluminal ultrasound)显像。1956年,Cieszynski将研制的超声导管用于心内超声测量研究,发现了超声导管用于诊断心脏疾病的可行性”。几年后,Kossoff研制出一种直径为2mm,工作频率为8MHz的超声导管用于心室壁厚度的测量,精度可达到0.lmm,开启了超声导管在诊断心脏疾病上的临床应用5。20世纪80年代末,微型超声换能器(超声探头)的发展使血管内超声应用于临床成为可能。图6显示了20世纪60年代到80年代出现过的血管内超声导管的雏形。
血管内超声技术未来的发展可能沿两个方向。一是血管内超声系统本身,体现为更清、更快、更准。“更清”指图像质量,波士顿科学和泰尔茂均上市了60MHz高清导管,国内研发的IVUS多为50MHz,与国外相应领域的进度差距不大,但在软件汉化及更新方面,国内企业更具优势。“更快”指回撤速度,目前血管内超生的儿个重要厂家均在做此项工作。“更准”指软件更加智能,包括自动管腔识别、模拟支架植入、虚拟组织学( virlual histology ,VH)等功能的应用。同时,超声主机硬件将拥有更高的计算能力,更大的存储空间,数据传输将更加便捷,并向无线传输发展。
另一个方向是血管内超声同其他腔内影像的整合。目前在研究的有IVUS-OCT双模一体化成像导管、IVUS-NIRS组合、血管内光声-超声-OCT三模态成像系统等。近年来,基于AI的IVUS影像分析和FFR快速计算技术( ultrasonic flow ratio.UFR)使得同步获取腔内影像学及生理学参数在未来成为可能,有望进一步拓展IVUS的应用场景。
作为一种血管内诊断手段,理论上,血管相关的疾病都可以使用IVUS。然而,IVUS的成用目前主要集中于冠脉血管,其在外周血管,如下肢动脉、肾动脉上应用较少;颅内动脉仍是血管内超声的禁区。如果将来的技术进步能够让超声导管足够细和柔软,颅内动脉或将成为IVUS下一个集中应用的领域。
中国冠脉IVUS血管内超声检测系统2020年市场规模约13亿元人民币,营收主要包括血管内超声导管耗材及相应的IVUS设备。截至2020年第一季度,中国市场仅有波士顿科学和飞利浦(收购火山)两家外企产品销售,波士顿科学市场占有率超过80%。
IVUS的临床价值在全球范围内已经得到了普遍认可,美国在PCI中应用IVUS的比例接近20%,日本达到90%,l欧洲发达国家也普遍超过15%。2019年中国以96.8万例冠脉PCI计算,IVUS的应用比例接近8%,浙江等省巿领跑全国,平均渗透率超过15%,但同时各省份之间渗透率存在明显差异,短期内渗透率还有较大的提升空间。
虽然IVUS图像阅读需要一定学习曲线,但随着优化PCI理念的不断深入,国产IVUS的研发进展以及具备IVUS应用能力的医师数量增加,中国IVUS渗透率2026年预期达到30%以上,市场规模超过50亿元人民币。
版权声明:本文采用知识共享 署名4.0国际许可协议 [BY-NC-SA] 进行授权
文章名称:《血管内超声(IVUS)的器械构成及技术趋势》
文章链接:
https://www.qixiezhixin.com/7291.html
本站所有非原创内容均来自转载或分享,仅供学习交流,不用于商业用途。如无意中侵犯了知识产权,请来信告知,将立即配合删除。Email:qixiezhongguo@qq.com