MRI虽然是优越的软组织分辨率和组织对比度,但是有时候还是需要注射对比剂进行增强扫描,提高病变和正常组织的对比。磁共振增强扫描在临床中用途也非常广泛,涉及全身各个部位、血管及功能成像。
根据对比剂磁化性质不同,可以把磁共振对比剂分为:顺磁性对比剂、铁磁性对比剂、超顺磁性对比剂。
根据对比剂增强的效果,可以把磁共振对比剂分为:阳性对比剂和阴性对比剂。阳性对比剂:就是指注射对比剂后,强化组织信号得到增强。简单来讲就是,对比剂能够增加组织的信号强度。反映在图像上就是,打药后,强化的组织(对比剂摄取多的组织),图像更白,变亮。阴性对比剂则和阳性对比剂相反,打药后,强化组织(摄取对比剂的组织)信号降低。反映在图像上就是,打药后,强化的组织信号下降,图像变黑,变暗。
临床中,最常用的磁共振对比剂主要是基于钆(Gd)的螯合物的顺磁性对比剂,Gadolinium-based Contrast Agents, GBGAs
这种对比剂主要是一种钆的螯合物。Gd离子带有3个正电荷,含有七个不成对电子,是一种顺磁性很强的金属离子,能显著缩短组织的T1弛豫时间;大剂量注射的话,还能够显著缩短周围组织的T2及T2*弛豫时间,达到增加组织之间对比度的目的。
GBGAs是阳性对比剂,所以一般打药后采用的扫描序列是T1加权像(T1WI)结合脂肪抑制。对比剂强化的效果取决于对比剂的弛豫率r1、对比剂浓度(首过效应)及组织本身的T1值。
前文链接:磁共振增强扫描如何量化对比剂效果
神经系统是MRI增强最常用的部位,其相关疾病的检出、诊断及鉴别诊断仅靠平扫是无法获得大部分相关信息的。首例对比剂的使用及MRI增强扫描就是用于头颅。

1984年,德国的Neurosurgical Review杂志发表了第一篇使用MRI对比剂诊断颅内肿瘤的。早期关于磁共振成像(MRI)的术语还不统一,当时很多国家还叫MRT(Magnetic Resonance Tomography)。
前文链接:核磁共振是怎么“变成”磁共振的?
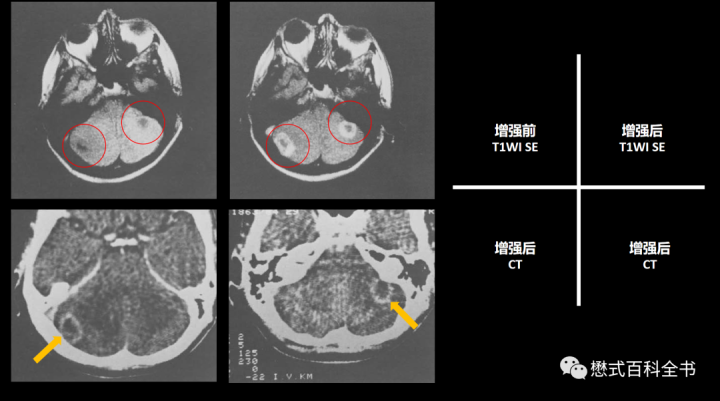
如图4所示,根据文献整理,一个支气管肺癌的病例,发现颅内小脑处有转移。由于当时CT扫描更薄,下排两个增强分别在不同层面显示了呈环形强化的病灶。上排两个图为MRI,均采用T1WI SE扫描(TR=400ms/TE=30ms):增强前(平扫)发现小脑两处低信号病变;增强扫描病变呈环形强化。
该案例说明增强MRI扫描能够提高颅内转移瘤的检出,并且和CT增强扫描效果一致。
头颅检出发现明显的占位病变需要诊断及鉴别诊断或者有其他原发肿瘤(特别是肺癌和乳腺癌)需要排除颅内是否有转移的,均需要进行MRI增强扫描。
头颅MRI增强主要的适应症或者作用是:
①鉴别肿瘤;
②发现转移瘤;
③早期诊断感染性病变及脱髓鞘病变;
④发现微小病变;
⑤血管性疾病的鉴别。
前文链接:磁共振头颅增强扫描规范及技术应用
血脑屏障(blood-brain barrier, BBB)完整及没有破坏的情况下,GBCAs是无法通过血脑屏障进入脑内的。而一些肿瘤或者炎症会破坏BBB,使得GBCAs可以通过破坏的血脑屏障进入脑内,产生增强的效果。
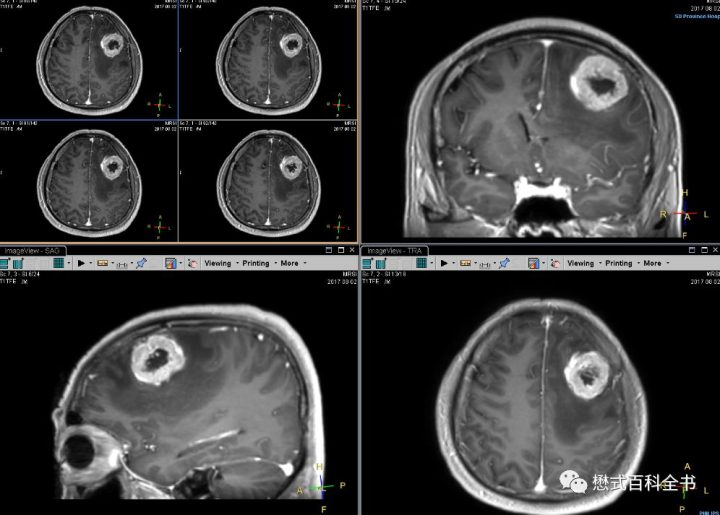
需要注意的是,虽然MRI增强可以反映肿瘤血供特征,但是图像上发现肿瘤组织均匀强化并不能说明该肿瘤组织是一个富血供肿瘤。比较典型的例子是淋巴瘤,淋巴瘤一般表现为均匀强化,但是打药灌注DSC和ASL大部分表现为低灌注。说明该肿瘤并不是一个富血供肿瘤,那么为什么表现为均匀明显的强化呢?就是因为血脑屏障破坏了,对比剂通过破坏的血脑屏障渗漏,使得肿瘤组织产生了“明显强化”的特征。
另外,对于转移瘤的探查,推荐采用延迟强化的方式。
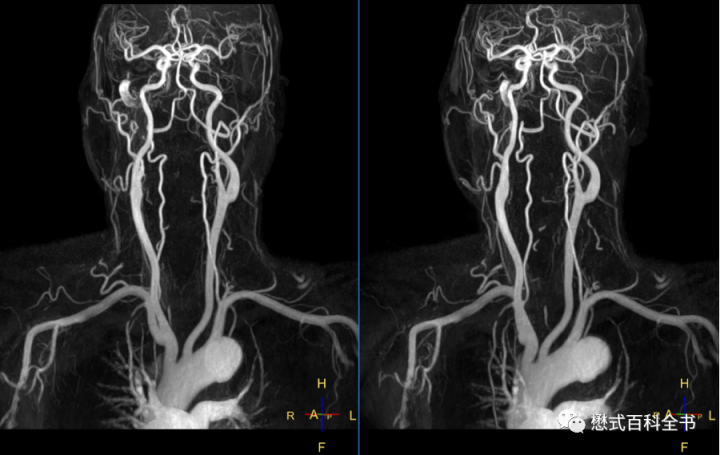
在常规的1.5T中,血液的T1值一般是1500ms~1800ms,脂肪组织的T1值大约为250ms左右,在T1WI上血液信号并不高。而打药后,由于对比剂缩短组织T1值的效应,可以使得血液组织的T1值下降到50~100ms,再结合脂肪抑制技术,在T1WI上血液及血管表现为明显的高信号达到血管成像的目的。
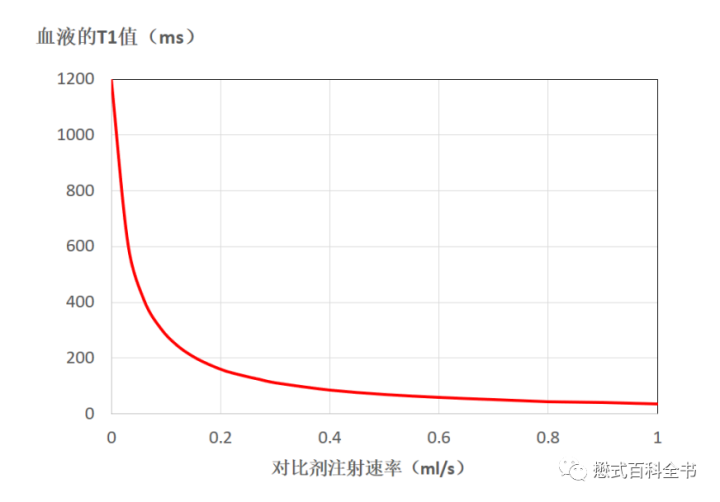
血液T1值的缩短和注射对比剂的浓度及注射速率有关。如上图所示,在注射速率达到0.4ml/s以上,血液的T1值显著缩短,达到1ml/s后,其T1值可下降到50ms。
所以,在进行CE-MRA的时候,尽管可以采用手推注射的方式,但是为了保证稳定的对比剂注射速率还是推荐采用高压注射器来完成。常规浓度的对比剂(0.5M),对比剂的剂量一般推荐0.1mmol/kg,也就是0.2ml/kg。如果要进行大范围的血管扫描,则可以适当地增加对比剂剂量,比如采用双倍剂量,甚至是3倍剂量。
CE-MRA要达到一个好的成像效果和血管显示,一个关键的因素在于时机timing。
注射对比剂后,对比剂首先通过静脉到达动脉,存在于动脉血管中,这个时期被称为血管期,又叫α期。这个时期比较短,取决于对比剂的剂量和注射速率。此后,对比剂通过血管渗透分布到细胞外间隙,这一时期称为间质分布期,又叫β期。
CE-MRA要抓住的时机首先是目标靶血管中存在对比剂的时机。其次,磁共振扫描并不是一瞬间完成的,一个序列扫描快则几秒~十多秒,慢则几分钟甚至10分钟。而决定图像对比剂的时间为信号采集时填充K空间中心的时间。
前往链接:MRI基本原理的难点突破——K空间
因此,最好的时机就是保证刚好采集数据K空间中心的时间和对比剂在目标靶血管的时间吻合(重合)。如何抓好血管扫描的时机,前面公众号有文章详细写了,这里不做赘述。
时机这个词上是:时间(time)+机会,也就是在关键的时间抓住机会。
这个时间是两方面的:
①对比剂通过目标靶血管的时间;
②扫描时采集数据填充K空间中心的时间。
这两个时间刚好匹配上了,那么就是抓住了最后的时机。
为了保证抓时机准确,文献、指南、专家共识和书籍推荐了很多方法,包括:经验法、小剂量测试法、透视触发监测法等。
一般还是推荐采用透视触发监测法,因为每个人的代谢情况不同,血管到达的时间不同,透视触发可以根据不同人的情况监测。
前文链家:磁共振透视技术
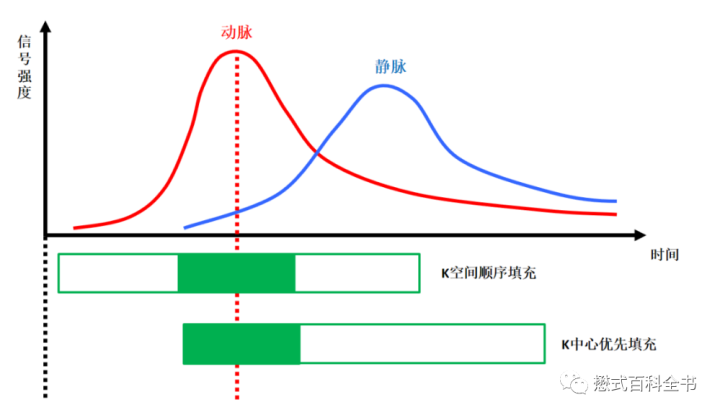
即使采用透视触发监测法,监测到了对比剂到达血管的时机,什么时间启动,还要考虑K空间的填充。如果是K空间线性填充,那么还需要提前启动,这个就不容易选择启动时期了。而大部分厂家的CE-MRA采用的K空间填充是K空间优先填充或者椭圆形填充。这样在启动扫描的一瞬间,首先填充K空间中心数据,能够保证抓时间的时效性。
相比于非打药的MRA,打药MRA扫描速度快,假阴性低,对于血管形态的显示更准确。
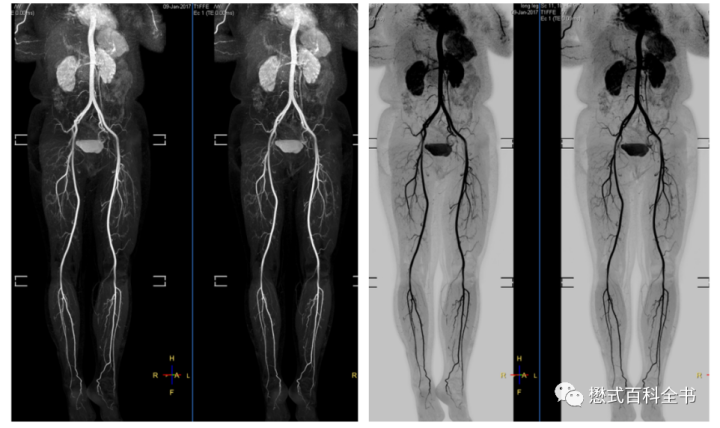
特别是对于需要大范围显示的血管,采用非打药方式,扫描时间比较慢。而CE-MRA可以快速的,多段显示血管,结合拼接技术,做到大范围血管可视化。
另外,CE-MRA结合超快速扫描技术可以进行4D血管成像。也就是超高时间分辨率扫描,显示对比剂从流入到流出的整个过程。
前文链家:4D MRA及Keyhole匙孔技术
这种4D MRA的增强扫描方式实际上是在对比剂注射(后)的一段时间来,利用超高速扫描(时间分辨率高)连续采集图像。这种增强方式也可以理解为动态增强扫描。
前面说的普通MRI增强和CE-MRA可以理解为静态增强扫描,也就是打药后,在某一个或者几个不连续的时间点采集信号。而动态增强则不同。
说到动态增强扫描,包括一些传统的动态增强扫描和功能性的动态增强扫描。
传统的动态增强扫描包括肝脏动态增强扫描,乳腺动态增强扫描,垂体动态增强扫描等。
传统的肝脏动态增强扫描包括几个经典的期相:蒙片(打药前-平扫)、(肝)动脉期(以动脉晚期为主)、门静脉期、实质期(平衡期),有必要还可以再进行延迟期。根据对比剂在体内的分布,肝细胞特异性对比剂比如钆塞酸二钠(Gd-EOB-DTPA)还有肝胆特异期。
有时候为了保证时相的准确性,避免遗漏某一个重要时相,还可能进行多动脉期扫描。
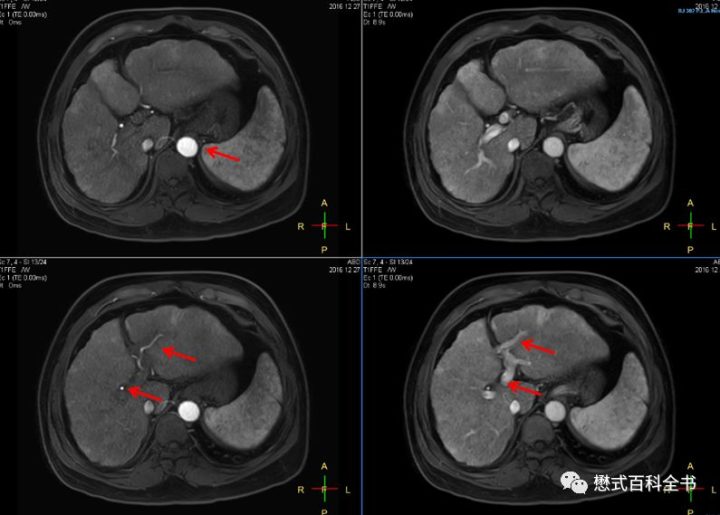
图13是一个典型的双动脉期,如何判断其是否准确。左边是动脉早期:可以发现腹主动脉明显强化,肝动脉显影,而门静脉并没有显影;右边是动脉晚期:可以发现腹主动脉,肝动脉及门静脉均显影,而肝静脉并没有显影。
肝脏的动态增强一般相对期相不多,经典的4个,多动脉期根据动脉的分期可能是6~8个。扫描完后,一般有经验的医生无需减影或者勾划时间-信号强度曲线,基本上就能判断病变的强化特征。
前文链接:肝脏动态增强扫描之准确地识别时相
而有些部位则需要减影或者以时间-信号强度曲线判断,比如垂体和乳腺。
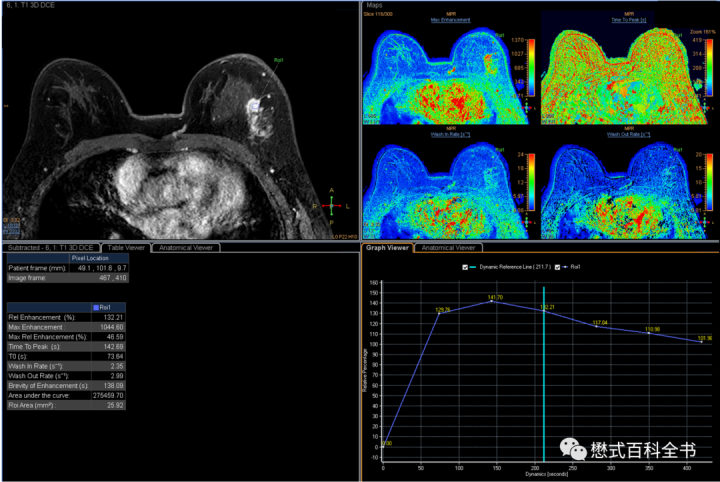
乳腺动态增强扫描,根据BI-RADS的指南,要求一个动态时间大概在60~120s,DCE扫描持续8分钟以上。大部分医院乳腺动态增强扫描方案一个动态持续时间大约90s,扫描6期(1+5),第一期为蒙片,也就是打药前。
前文链接:磁共振乳腺扫描大全
垂体则根据需要,不是所有的垂体病变诊断都必须进行动态增强扫描。如果是垂体大腺瘤则不需要动态增强,而垂体微腺瘤一般推荐采用动态增强扫描的方法。
需要注意的是,垂体动态增强扫描,一般对比剂用量是半剂量,这样便于判断正常垂体和微腺瘤的不同强化特征。动态扫描完建议再进行延迟扫描。

动态增强扫描除了能够动态的观察组织或者病变强化特征,还能够绘制时间-信号强度曲线,这一点是一个比较大的优势,可以半定量的进行分析。
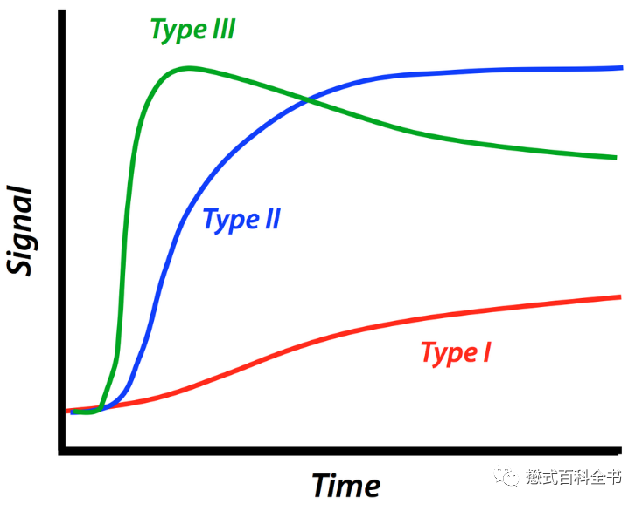
如图16,时间-信号强度曲线,横坐标为时间(也可以用动态数来表示),纵坐标一般为信号强度(也可以换算为对比剂浓度,这样可以反映血流动力学特征)。通过这种方式可以半定量地分析不同组织的强化特征,也可以直接观察曲线形态,判断不同病灶的强化模式。比如大家熟悉的:流入型、平台型、流出型(快进快出)。
流入型(Type Ⅰ):随着动态或者时间延长,逐渐强化。这种大部分是良性的。
平台型(Type Ⅱ):早期明显强化后,随着动态或者时间延长,信号强度逐渐稳定,变化范围在最大强化峰值的10%以内。这种大部分也是偏良性的。
流出型(Type Ⅲ):早期明显强化后,达到峰值后迅速下降,下降幅度大于峰值的10%。这种一般是恶性肿瘤的表现,比如大家熟悉的肝细胞癌(HCC)的快进快出表现。
心肌首过灌注也是类似的技术,只不过其时间分辨率更高。
前文链家:心脏磁共振技术大全(五)
不止是首过灌注,打药扫描在心脏磁共振中应用还是比较多的,包括首过灌注、延迟强化以及组织定量测量技术。
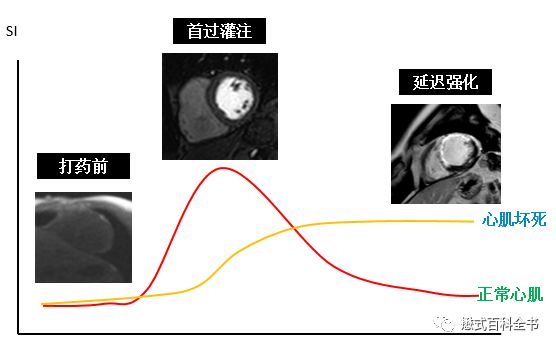
MRI打药的动态增强简称DCE,是Dynamic Contrast Enhanced动态对比增强的首字母缩写。讲到这里,大家自然而然想到一个词:灌注。
和CT灌注不同,MRI的灌注含义非常丰富。如果不具体用专业属于描述清除灌注的定义,只说磁共振灌注,则无法准确的传递出要表达的具体技术。
前文链接:磁共振到底有几种“灌注”?!
前面提到了半定量的DCE,还有神经系统用得比较多的一种“灌注”,叫做DSC,全称Dynamic Susceptibility Contrast动态磁敏感对比成像。
DSC虽然也是用的阳性对比剂GBCAs,但是用到的是对比剂的另外一个效应,就是顺磁性对比剂影响局部磁场。由于有血脑屏障,并且假设血脑屏障完整,则GBCAs无法通过血脑屏障而直接作用于脑组织,这使得血管内和脑组织之间可以建立起磁敏感梯度。这也是DSC这个名称的由来。对比剂通过血管时,顺磁性的对比剂和周围组织形成局部磁场不均匀,产生T2*效应,缩短周围组织的T2值和T2*值,使得信号下降。
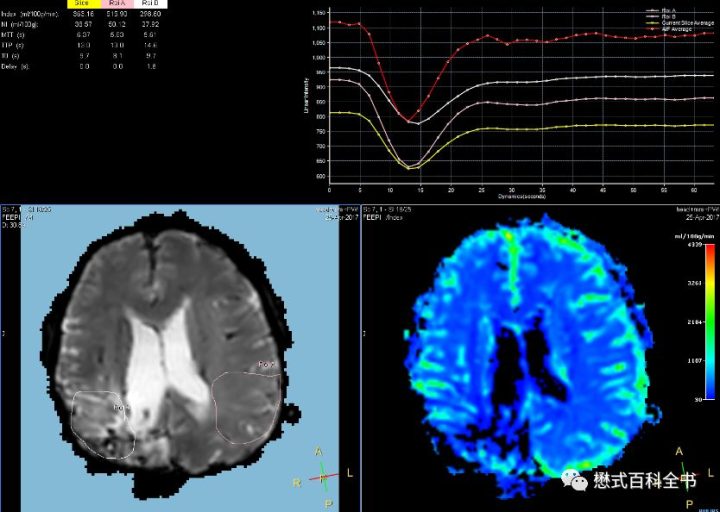
DSC需要大剂量团注,利用对比剂首过(first-pass)效应,采用GRE-EPI序列采集。对比剂通过时,信号下降,可以通过绘制时间-信号强度曲线,计算头颅灌注的血流动力学参数。
前文链接:磁共振脑(神经)“灌注”DSC技术
需要注意虽然DSC可以得到一些指标参数比如:rCBV、rCBF、MTT、TTP、T0、Tmax等,但是这种灌注还不是真正意义上的定量灌注。得到的这些数值也只是可以用于半定量。这和核医学和CT灌注是完全不同的。
CT灌注(CTP)是一种定量技术,其基本的理论来源于核医学放射性示踪剂稀释原理。CTP可以得到反映组织灌注特征的多种参数,并且这些参数是绝对的定量值,并不是相对的比率或者比值。
通过CTP,我们可以得到几个反映灌注信息的特征性参数。脑血容量(Cerebral Blood Volume, CBV),单位是ml/100g,每100g脑组织多少毫升、脑血流量(Cerebral Blood Flow, CBF),单位是ml/100g/min,每分钟通过每100g脑组织的容积,多了一个时间、对比剂平均通过时间(Mean Transit Time, MTT),单位是s秒、对比剂达峰时间(Time To Peak, TTP)等参数。
其中,根据中心容积定律,有:CBV=CBF×MTT。或CBF=CBV/CBF。
CTP需要使用对比剂,这种对比剂一般是碘剂(比如,碘普罗胺),研究发现,在平均能量为120keV的情况下,每1mg碘,能够使每1ml组织CT值增加25HU。
而MRI的所谓神经灌注DSC的信号强度衰竭和对比剂浓度并不是线性的关系,因此磁共振灌注不能叫做MRP,而是DSC。
当然,MRI也有全定量的灌注,这就是在DCE的基础上,通过提高时间分辨率,计算组织的T1 mapping进行的灌注。
前文链接:DCE技术——渗透性分析
为了和普通的灌注或者前面的半定量灌注相区别,一般把这种定量的灌注叫做渗透性分析或者通透性分析。
这种定量灌注或者渗透性分析可以得到一些反映毛细血管通透性的参数。
Ktrans:transfer constant,又叫容积转移常数,代表物质由血浆(血管内)转移(渗透)到组织间隙的灌注参数(转移常数),单位是(1/min)。这个参数有时候又被叫做渗透分数(Permeability),是组织灌注的一个主要指标。一般血液把能量及物质输入给组织,则物质从血浆传递给组织,反映组织对血管能量物质的摄取,所以这个参数是最重要的一个灌注参数。血浆→组织间隙。
Kep:rate constant,又叫速率常数,代表物质由组织间隙回到血浆的灌注参数(转移常数)。组织间隙→血浆。
Ve:extravascular extracellular volume,V代表体积Volume,extr-前缀外,vascu削刮词根,cell词根细胞。Ve就表示血管外-细胞外体积分数。既然是一个分数,肯定就有分母和分子,这个分数是什么比(占)什么的百分数呢?其实,光看Ve的解释,并不知道是什么分数,其实Ve表示的是The volume fraction of EES per tissue volume。也就是EES占单位体积的分数。由图所示,其实就是代表整个单位体积里,(血管外-细胞外)组织间隙所占的容积分数。反映的是血管外组织细胞分数。
Vp:capillary plasma volume,跟Ve类似。Vp则代表血管内体积分数,它的正确描述应该是The volume fraction of plasma per tissue volume,代表血浆占单位体积的分数。反映的是局部毛细血管密度。
还有一个重要的公式,那就是Kep=Ktrans÷Ve。


可以说MRI增强扫描或者打药MRI扫描用于磁共振检查的各个部位和技术。还有一种组织定量技术会需要打药。
磁共振定量技术一般是采用特殊的磁共振序列或者技术测量一些组织相关的定量信息,包括组织弛豫特征参数(T1 mapping、T2 mapping、T2* mapping…)及其他定量指标(脂肪定量、磁化率定量QSM、铁定量、蛋白定量APT等)。
前文链家:磁共振定量技术(一)
一般大部分定量技术平扫就可以,不需要打药,比如T2 mapping、脂肪定量、QSM。
而另外有一些定量技术需要配合打药,下面就介绍几种:
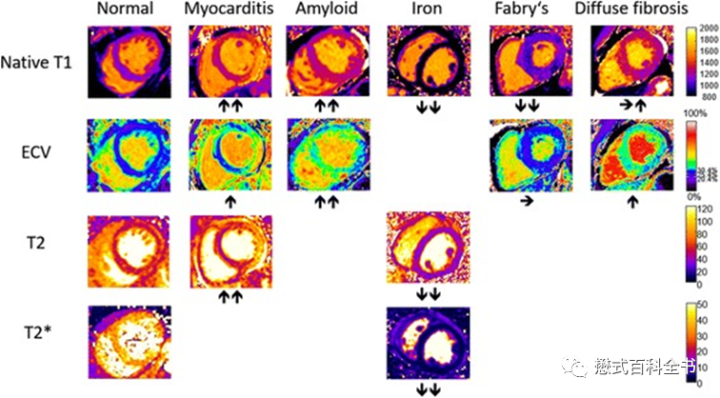
首先是心脏的T1 mapping。本身T1 mapping技术不需要打药,可以直接通过定量序列测量组织的T1值。但是我们知道打药后,一般会缩短组织的T1。心脏的T1 mapping不单是为了测量非打药时候的组织T1值(native T1),还需要通过技术测量Extracelluar Volume, ECV细胞外间隙。

- Schörner W, Kazner E, Laniado M, et al. Magnetic resonance tomography (MRT) of intracranial tumours: initial experience with the use of the contrast medium Gadolinium-DTPA [J]. Neurosurg Rev, 1984 ;7 (4): 303-312.
- Reichert M, Morelli JN, Runge VM, et al. Contrast-enhanced 3-dimensional SPACE versus MP-RAGE for detection of brain metastases: considerations with a 32-channel head coil [J]. Invest Radiol, 2013; 48 (1): 55-60.
- Messroghli DR, Moon JC, Ferreira VM, et al. Clinical recommendations for cardiovascular magnetic resonance mapping of T1, T2, T2* and extracellular volume: A consensus statement by the Society for Cardiovascular Magnetic Resonance (SCMR) endorsed by the European Association for Cardiovascular Imaging (EACVI) [J]. J Cardiovasc Magn Reson, 2017, 9; 19 (1): 75.
- Burstein D, Velyvis J, Scott KT, et al. Protocol issues for delayed Gd(DTPA)(2-)-enhanced MRI (dGEMRIC) for clinical evaluation of articular cartilage [J]. Magn Reson Med, 2001; 45 (1): 36-41.
- Zilkens C, Tiderius CJ, Krauspe R, Bittersohl B. Current knowledge and importance of dGEMRIC techniques in diagnosis of hip joint diseases [J]. Skeletal Radiol, 2015; 44 (8): 1073-83.