dGEMRIC打药(离子型Gd对比剂)后延迟一定时间测量软骨T1值来间接反映糖胺聚糖GAG含量的技术。dGEMRIC是否可以作为一种关节软骨糖胺聚糖GAG的生物标记物biomarker呢?
本期介绍一种定量评价关节软骨的技术,可以说是关节软骨生化成像技术——dGEMRIC。
关节软骨生化成像技术分为平扫生化成像和打药生化成像。平扫的技术很多,包括前面讲过的一些定量技术:T2 mapping、T2* mapping、T1ρ mapping、化学交换饱和转移及软骨DWI。
前文链接:
骨关节炎早期改变主要是关节软骨(articular cartilage)的退变。传统的影像学检查手段对于关节软骨的显示(可视化)及评价作用有限。
软骨组织主要由细胞外基质(extracellular matrix, ECM)和分布在其中的软骨细胞(2%左右)构成。而ECM又是由水(60%-80%)、II型胶原蛋白(15%-20%)、proteoglycans(PG,蛋白聚糖,也可以翻译为蛋白多糖)(3%-10%)组成。根据软骨组织内所含纤维的不同,可以将软骨分为三种:透明软骨、弹性软骨及纤维软骨。
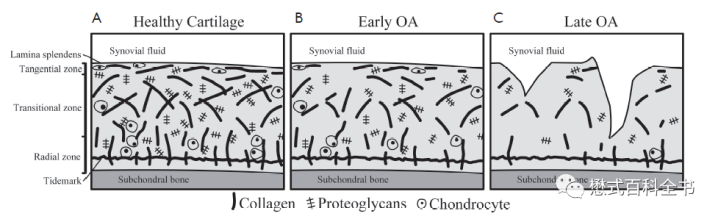
上图所示,不同病理阶段,软骨组织成分有明显不同。图中画黑线条的是Collagen胶原蛋白;画着类似鱼骨的是Proteoglycans则是蛋白聚糖(也可以翻译为蛋白多糖,本文使用蛋白聚糖,后面不再重复);画着一个圆圈打一个点的是Chondrocyte软骨细胞。
图中(A)显示健康人(没有OA),软骨组织结构正常,在关节面和骨面之间显示几个不同分层,胶原纤维及蛋白聚糖含量丰富。(B)则是早期骨关节炎的软骨组织,蛋白聚糖含量减少,胶原基质开始崩解。(C)是晚期骨关节炎的软骨组织改变,此时蛋白聚糖大量消耗,软骨结构也发生明显改变。
蛋白聚糖(PG)是由糖胺聚糖(glycosaminoglycan, GAG)以共价的形式与线性多肽连接而成的多糖和蛋白复合物,它们能够形成水性的胶状物。
dGEMRIC是一种可以定量地检测关节软骨中糖胺聚糖GAG分布的磁共振技术。该技术的原理是基于正常生理状态下GAG含有羧基蛋白酶(carboxyl)和硫酸盐基团(sulfate groups),带负电荷。由于电荷的同性相斥、异性相吸,负电荷吸引带正电荷的离子和水进入软骨;排斥带负电荷的离子。
离子型Gd对比剂,比如Gd-DTPA(钆喷酸葡胺)带负电荷,静脉注射钆剂以后,经过一定时间代谢,由于同性相斥,GAG和钆对比剂相互排斥,对比剂只分布在GAG缺失的部位,也就是在T1WI中显示信号增强的地方。
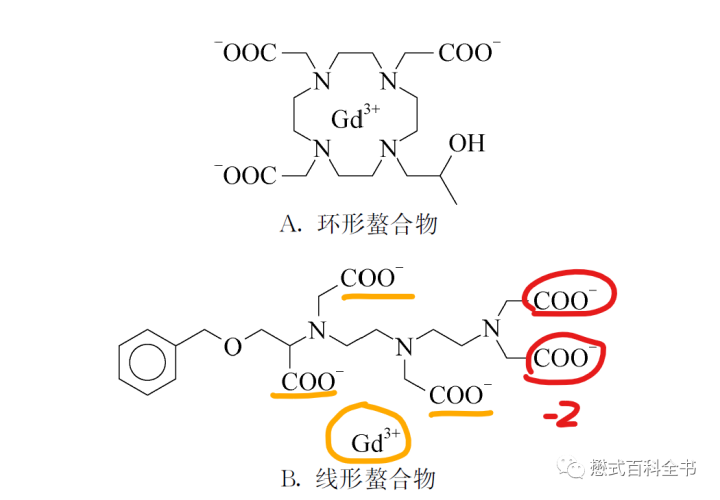
根据钆对比剂的化学结构类型,可以分为线性螯合物和大环状螯合物。线性螯合物中的配体是“开环”的,大环状螯合物,Gd3+离子被“固定”在配体形成的环形中。根据钆对比剂离子情况(是否带电荷),可以分为离子型对比剂和非离子型对比剂。如图2所示,Gd-DTPA是离子型对比剂,带两个单位负电荷。
注意如果使用的是非离子型对比剂(也就是不带电荷的),则不能到达dGEMRIC技术的效果。
测量T1值可以反映dGEMRIC指数从而间接反映GAG含量。这种方法需要打药,并且扫描时间长,主要是打药后需要延迟。
最早一篇文章发表于1996年,介绍了这种技术。当时使用的对比剂也是离子型对比剂Gd-DTPA,当时用的是Gd-DTPA2-表示带两个负电荷。
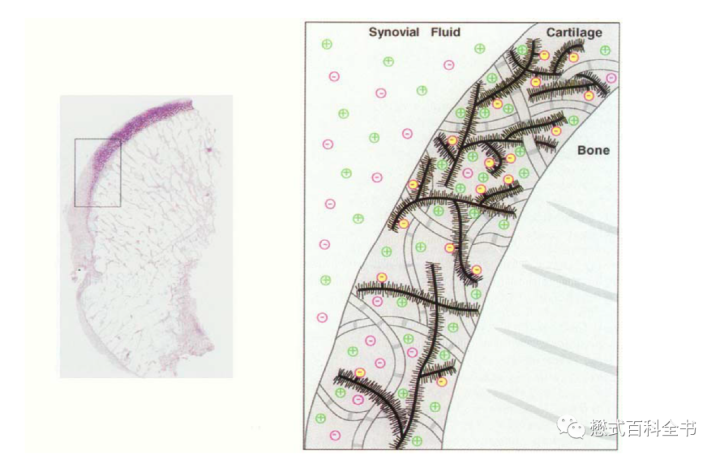
如图3所示,左边的图片是股骨头组织切片进行糖胺聚糖GAG染色显示。其中顶部显示正常的软骨区域,由于GAG浓度高,表现为蓝色染色区;中间是解剖结构完整但是退化的组织,由于GAG含量低,没有染色区;下面是软骨完全退化的区域。方格显示GAG含量降低的边界区域在右图,组织由胶原基质(collagen matrix)(图中灰色网格线显示)和蛋白聚糖(黑色瓶刷线显示)。蛋白聚糖具有糖胺聚糖GAG侧链,GAG含有羧基蛋白酶(carboxyl)和硫酸盐基团(sulfate groups),带负电荷。
图中黄色圆圈带负号的表示带负电荷的离子基团,固定在软骨基质上。与周围溶液中的浓度相比,高浓度的固定电荷密度(FCD)使得相对高浓度的可移动正离子(带正电荷,例如Na+,图中用绿色圆圈+号表示)聚集;排斥带负电荷的离子,使得可流动负离子(带负电荷,例如Gd-DTPA-,图中用粉红色圆圈-号表示)表现为低浓度。
可以直观地看出,GAG缺失的部分,Gd-DTPA-聚集。
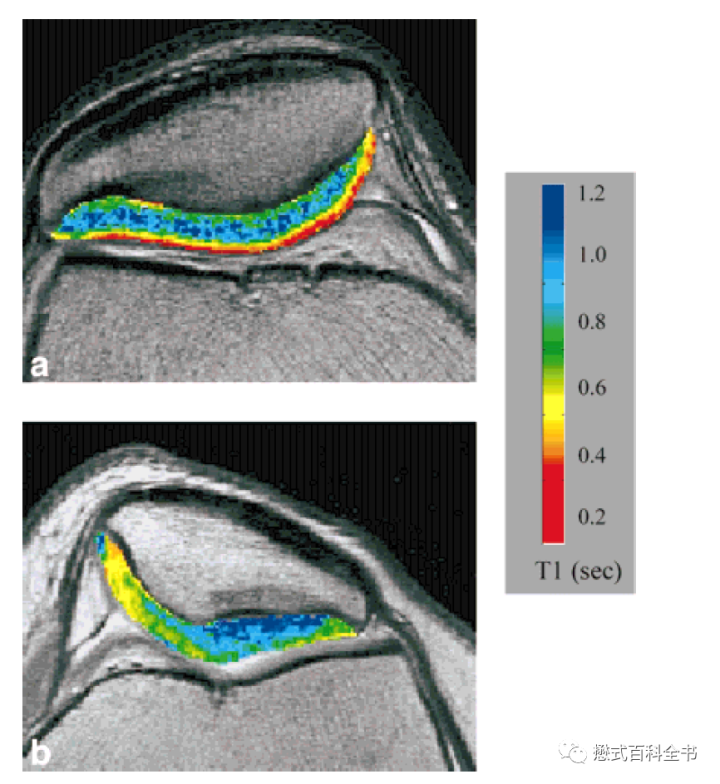
注射离子型Gd对比剂后,延迟充分的时间,使得对比剂有时间渗入软骨组织。对比剂主要分布在蛋白聚糖缺失的部位,也就是在T1WI中显示信号增强的地方。通过测量打药延迟后的T1值,也就是dGEMRIC指数从而间接反映GAG的含量。
打药前测量软骨组织的T1值称为Native T1,这个和心脏的T1 mapping类似。
前文链接:磁共振定量技术(四)T1 mapping
注射离子型Gd对比剂后,延迟扫描,测量软骨组织的T1值,称为T1Gd或者dGEMRIC指数或者T1Gd mapping。和心脏T1 mapping不同,由于人体中软骨组织平扫测量的T1值差异不大(Native T1),所以可以直接用打药后延迟测量的T1值作为dGEMRIC指数。
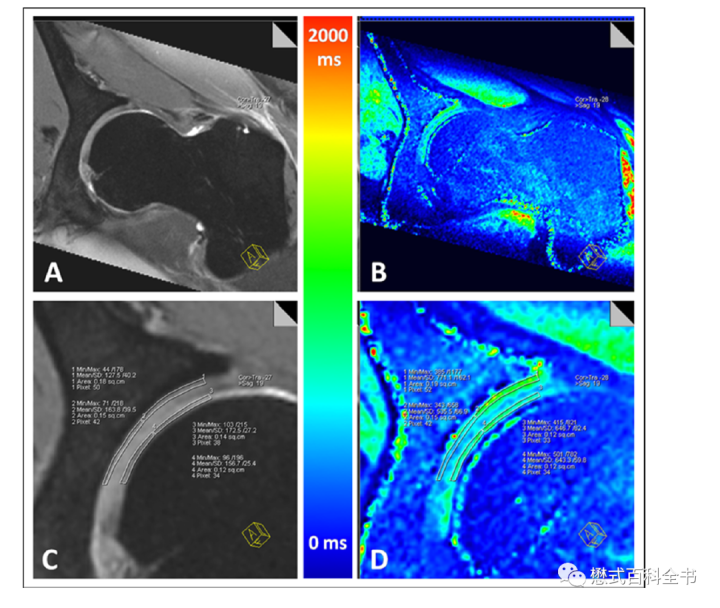
-
Matzat SJ, van Tiel J, Gold GE, Oei EH. Quantitative MRI techniques of cartilage composition [J]. Quant Imaging Med Surg, 2013, 3 (3): 162-74. - Buckwalter JA, Mankin HJ. Articular cartilage: tissue design and chondrocyte-matrix interactions [J]. Instr Course Lect, 1998; 47: 477-86.
- Bashir A, Gray ML, Burstein D. Gd-DTPA2- as a measure of cartilage degradation [J]. Magn Reson Med, 1996; 36 (5): 665-73.
- Burstein D, Velyvis J, Scott KT, et al. Protocol issues for delayed Gd(DTPA)(2-)-enhanced MRI (dGEMRIC) for clinical evaluation of articular cartilage [J]. Magn Reson Med, 2001; 45 (1): 36-41.
- Zilkens C, Tiderius CJ, Krauspe R, Bittersohl B. Current knowledge and importance of dGEMRIC techniques in diagnosis of hip joint diseases [J]. Skeletal Radiol, 2015; 44 (8): 1073-83.