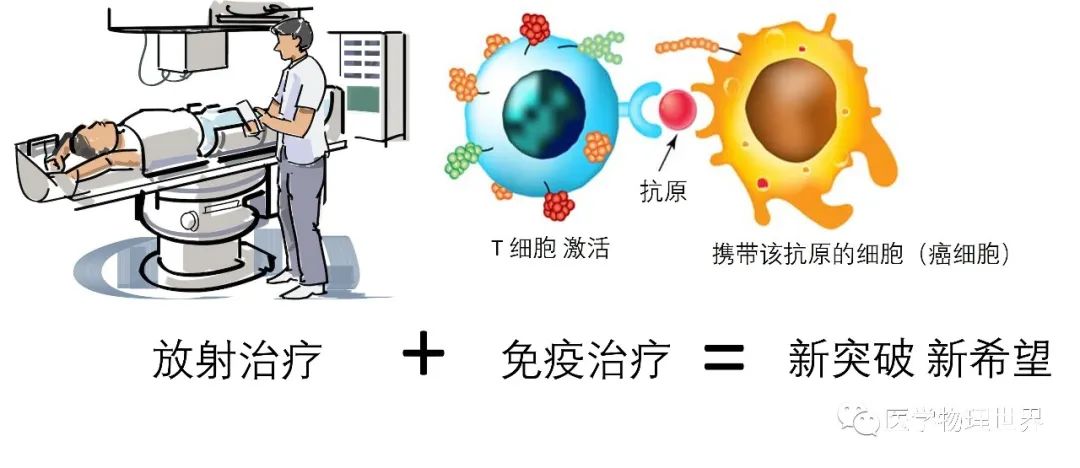
大部分被诊断为恶性肿瘤的患者将在病程中接受放疗,在以治疗或缓解病痛为目的的传统上,以往放射治疗的有效性仅被解释为治疗体积内针对肿瘤细胞DNA的不可修复性损伤,导致细胞死亡或丧失复制潜能。在过去的几年里,免疫检查点抑制剂的出现,改变了很多恶性肿瘤的治疗现状,为抗肿瘤治疗提供了新的努力方向和希望。
然而,越来越多的数据表明,免疫系统也是放疗反应的关键性决定因素,放射和免疫联合治疗可能是协同作用。这种联合可能提供一种非药理学、低毒性和较经济的方法来增加全身反应和最大限度地增加肿瘤细胞的死亡。
本文主要基于免疫时代的到来改变了恶性肿瘤治疗模式、放疗与免疫治疗联合的理论机制,及在联合治疗过程中需要关注的问题展开,并提出了对联合方案的优化,并对未来将面临的挑战和发展方向提出总结与展望。
免疫治疗时代的到来
放疗与免疫治疗的理论机制
许多显著的证据表明放疗在全身抗肿瘤反应中的免疫调节作用。更令人注意的是, 在许多临床病例报告中观察到一种现象,发现在射线辐照范围之外的肿瘤发生消退,称为辐射依赖性远隔效应。
不幸的是,即使远隔效应目前已经被广泛认知,但其发生的罕见性似乎表明其应用价值比较局限。ICIs 的使用增加也为与放疗联合使用以产生远隔效应提供了机会, 其中放射到转移性疾病的一个部位,可能会在遥远的非照射部位的肿瘤也产生消退。然而,远隔效应的机制尚未明确, 且目前仅报告了有限的远隔效应病例。
- 放疗增加肿瘤抗原的释放
- 放疗调节肿瘤微环境
除此之外,放射线对肿瘤微环境也会产生负性调节, 如诱导免疫抑制细胞因子的分泌,转化生长因子-β 在辐射后很短时间内就会上调,其抑制 CD8+T 细胞的杀伤功能,并促进调节T细胞(Treg)聚集,同时促肿瘤巨噬细胞的积累。从而导致肿瘤微环境免疫功能受到抑制。
- 放疗作为“原位”疫苗的潜力
然而, 由于基因组突变改变了蛋白质序列, 新抗原还会在癌细胞中表达。这种类型的抗原具有肿瘤特异性,在激活时可引发足以清除肿瘤细胞的免疫应答。除了释放肿瘤新抗原外,辐射还介导某些内质网蛋白在细胞凋亡前易位到细胞膜,包括钙网蛋白。DAMPs 作为一种危险信号,如高迁 移率族蛋白组框 1 (HMGB1)和三磷酸腺苷,从受射线照射后的肿瘤细胞的细胞质释放到细胞外环境中,使 DC 能够识别垂死的细胞并吞噬它们。HMGB1 诱导 DC 成熟,使 DC 更有效地向 T 细胞 呈递抗原。该过程由 I 型 IFN 介导,并通过检测癌细胞来源的 DNA 起作用。活化的 DC 迁 移到局部淋巴结,幼稚 T 细胞被肿瘤细胞特异性抗原呈递和刺激,导致它们成为效应 T 细胞并返回肿瘤 组织,被照射反应产生的趋化因子吸引。
因此,照射的肿瘤可以描述为在原位自动疫苗接种的过程中成为肿瘤抗原的来源。此外,在辐射肿瘤细胞上表达的细胞间粘附分子- 1 (ICAM- 1)、Fas 死亡受体和 MHC- 1 类抗原呈递分子允许活化的抗肿瘤效应 T 细胞(尤其是 CD8+T 细胞)轻松识别肿瘤细胞,从而杀死它们。
据推测,辐射通过这些过程可 以激活下游免疫反应并刺激免疫监视的细胞死亡,这种特征成为免疫原性, 这导致了“原位 ”疫苗接种 效应。
免疫时代肿瘤放疗需关注并解决的几个问题
- 最佳排序
2014 年的一项研究表明,在放疗的同时使用抗 PD-L1 抗体优于连续放疗后使用抗PD-L1抗体。
此外,在一名黑色素瘤患者中,Stamell 等人还观察到伊匹单抗与立体定向放疗同时使用后存在远隔效应。可见,三种治疗模式都有一定的临床证据和理论支持。
- 放疗剂量
事实上,与传统方法相比, 每次分割高剂量消融的放疗被认为是增强抗肿瘤免疫应答的更好治疗方案。
SBRT 的大分割方式能明显诱发抗原特异性 T 细胞和 B 细胞介导的免疫反应,当联合免疫治疗时,重新编程肿瘤微环境,增强免疫刺激效应,促进肿瘤抗原呈递,增加抗原特异性 CD8+T 细胞进入肿瘤。
尽管大多数临床数据表明,较大分割剂量可能会增强远隔反应,但其他临床研究并未取得良好的结局,这意味着远隔效应受到多种因素的影响。根据放疗的剂量和分割,可能存在最佳阈值或剂量范围。
因此,临床中应仔细考虑这些不同的方案与其不同的治疗结果,以便在放射免疫联合治疗的背景下开发 放疗的最佳剂量和分割方案,以更有效地诱导抗肿瘤的远隔作用。
- 放疗方式
目前看来,调强适形放疗联合免疫治疗更容易增强远隔反应。但是对于其他放疗方式的反应缺乏临床数据的支持,这提示我们在临床工作中应该根据不同肿瘤、 不同患者机体状况来制定最适合患者的个体化联合治疗方案。
- 联合治疗的毒副反应
此外,放疗联合 ICIs 似乎比放疗联 合靶向或化疗药物更耐受性好。
因此,在临床工作中面对不同类型的肿瘤,在制定联合方案的同时, 应根据不同 ICIs 的作用机制,更好的避免患者发生严重不良反应。
- 指导放疗对免疫功能评估的生物标志物
然而,鉴于该回顾性研究的患者数量有限,需要更多的临床调查来评估放疗的局部反应和ALC对全身异位效应的预测作用。
迄今为止,免疫检查点治疗的重点是通过PD-1 、PD-L1和CTLA-4抑制来逆转T细胞的衰竭状态。然而,目前只有一小部分患者受益于 ICIs。
因此,针对其他免疫检查点(如 LAG3)的单克隆抗体(mAbs) 的开发具有相当大的兴趣。已有研究表明,LAG3 和 PD- 1 在肿瘤浸润淋巴细胞(TIL)上特别表达, 并产生协同作用可以促进肿瘤免疫逃逸。
因此,大量的临床前数据导致 LAG3 成为临床中针对的第三个检 查点,并有目前正在临床试验中针对癌症的 LAG3 靶向免疫疗法的开发进行研究。
众所周知,p53 是一种肿瘤抑制基因,在调控肿瘤细胞的增殖、凋亡和 DNA 修复中起着重要作用,其编码蛋白 p53 是影响细胞周期开始的转录因子。然而,在恶性肿瘤患者中 p53 突变的概率大于 50% ,突变的 p53 将失去抑制癌细胞增殖的能力,成为肿瘤发生的罪魁祸首之一。
近年来,许多研究表明p53的状态可以调节放疗的体外抗肿瘤作用。在小鼠模型系统中, Strigari 等人在 20 Gy 或 10 Gy 辐照后,发现受辐照的野生型 p53 突变肿瘤的生长受到抑制。然而,在未受辐射的野生型 p53 突变肿瘤中,无论剂量如何,均未观察到明显的肿瘤生长延迟。Camphausen 等人在其研究中也观察到类似的结果,在 p53缺失小鼠和 p53 被 pifithrin-a (一种可以阻断 p53 通路的药物)抑制的小鼠中均未观察到异位的抗肿瘤作用 。
因此,我们可以假设 p53 依赖信号可能与放疗的全身性抗肿瘤作用有关, 而评估 p53 在体内的状态 可以用来预测放疗的癌症患者发生体外效应的可能性, 从而提供更好的治疗给药。
总结
随着更多的临床前与临床研究带来的数据, 放疗联合免疫治疗的方案会更加规范、专业、精准、安全, 为恶性肿瘤患者的治疗带来更好的治疗环境。
值得注意的是,在联合治疗的临床实践中, 面对不同的恶性肿瘤、不同患者的机体情况, 应该注重培养个体化治疗思维,为患者谋求治疗利益最大化。
本文来源:陈悦,赵红.放疗与免疫治疗在恶性肿瘤治疗中的相互作用.临床医学进展,2023,13(7):11272-11279.
作者:陈悦 赵红