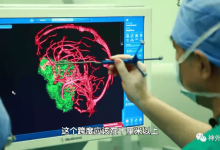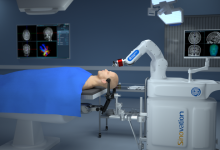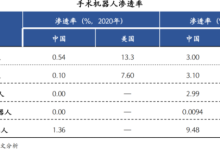
神经导航技术(Neuronavigation),又称图像引导神经外科(Image-guided neurosurgery,IGNS),是基于CT、MRI等术前影像数据建立图像引导空间,借助光学(或磁学)跟踪仪实时跟踪显示手术器械相对于脑组织和病变部位的位置关系,从而达到指导医生进行手术操作的目的。
在这个系统中,术前影像就类似于GPS道路地图,而光学(或磁学)跟踪设备可以跟踪手术器械,则类似于GPS定位信号。
在神经外科中,导航技术已应用于脑肿瘤、血管畸形、脊柱和功能神经外科等主要分支,成为不可替代的手段之一。
神经外科导航技术改变了传统的开颅手术模式,实现了脑内病灶的准确定位,对提高脑肿瘤的切除率、降低手术并发症与死亡率具有重要的临床价值。
技术原理
无框立体定位导航的基本原理是:使用患者术前自身影像数据创建 图像引导空间,借助解剖标记物或者能在图像上清晰成像的人工标记物 将患者空间配准到图像空间,利用光学(或磁学)跟踪仪实时跟踪探针在患者空间中的位置,将其转换到图像空间并以虚拟探针的形式 叠加在三维图像空间中。医生可通过高解像度的显示屏从各个方位(矢状位、冠状位、横断位、三维立体模型等)观察探针与病灶以及重要解剖结构之间的位置关系,以便在手术时避开重要功能结构,减少病患的手术创伤。
技术简史
导航的概念最早见于1907年Horsley和Clark在小动物身上的研究。他们借助于体外的解剖标志来确定体内脏器的位置。
1947年,Spiegal和Wycis借助“气脑造影术”的技术给软组织成功定位,并开创了导航在人体手术的应用。同期间,瑞典的Leksell和Riechert,法国的Talaiach也发展了各自基于投影影像技术的定位方法。
20世纪50到60年代,基于平面影像的导航技术被广泛应用于丘脑切开术。之后,CT的出现使三维图像成为现实,大大推动了导航技术的发展.
1986-1987年间,Watanabe、Roberts及Basel多人几乎同时开发出不同的导航系统。其后的二十年间,神经导航技术得到了飞速发展和广泛应用,这依托于诸多先进医学影像技术的出现,如功能磁共振成像(functional MRI)、核磁共振弥散张量成像(MRI-DTI)、核磁共振弥散加权成像(MRI-DWI)、核磁共振波谱分析(MRS)、核磁共振灌注成像(PWI)、磁源成像(MSI)、脑磁图(MEG)、正电子发射断层成像(PET)、术中超声、术中CT/MRI的,以及电生理监护技术的发展。除了影像技术的进步,导航系统中的定位技术也日臻成熟。
应用范围
神经导航技术已广泛应用于神经外科的多个分支,诸如脑肿瘤(胶质瘤、脑膜瘤、转移瘤、淋巴瘤等)、脑血管畸形、癫痫外科手术(致痫灶切除术、胼胝体切开术)、脑深部电刺激器植入术等。
国内外已有不少文献报道了在各种神经外科手术中,神经导航对于病灶精确定位、最佳手术入路选择、提高病变全切率、以及降低术后并发症方面的积极意义。例如:英国神经外科医生John Wadley在1999年发表的论文中,使用前瞻式(prospective)的研究设计,分析了2年中(1998-1999年)300例神经外科手术中的神经导航技术应用。这300例神经导航手术覆盖了神经外科多个分支和多种神经外科手术类型,包括163例开颅术、53例立体定向下活检、7例神经内镜以及37例复杂的颅底手术。从病理分型分析,包括98例胶质瘤、64例脑膜瘤以及23例转移瘤。研究中发现, 99%的神经外科医生能从导航的使用中增加对手术的信心,95%的神经外科医生认为在这些病例中借助神经导航技术要优于传统手术。此外,瑞典的Eboli医生还报道了神经导航在经蝶骨垂体腺瘤切除术(transsphenoidal pituitary adenomectomy)中的成功应用。
国内的相关研究也有类似结论。例如解放军301医院神经外科医生孟祥辉在2004年报道了22例应用神经导航的神经外科手术结果,其应用范围包括胶质瘤(14例)、脑膜瘤(2例)、海绵状血管瘤(4例)、淋巴瘤(1例)以及转移瘤(1例)。总之,迄今为止神经导航在国内外都已得到了较为广泛的应用,覆盖了不同疾病和手术类型。
应用流程
手术导航系统的核心包括 图像和定位两部分,分别类似于航行中的“地图”和“罗盘”。首先,医学影像学的图像数据被传输到导航仪,这些数据可以包括计算机断层扫描(CT),核磁共振(MRI),正电子发射计算机断层扫描(PET),数字血管剪影(DSA)等。二维的数据经过导航仪的电脑分析处理,得到三维立体图像,作为导航手术的“地图”。接下来,通过对患者头部标记(marker)的注册(registration), 将手术室中的患者实际头部位置和导航仪中的患者头部三维图像对应起来。
值得一提的是,患者在神经导航系统中的基础图像可以与其他影像学图像(如功能核磁共振、脑磁图等) 以及电生理实验结果(如脑皮层功能区电刺激定位图,cortical mapping by electrical stimulation)相融合,这样使神经导航不仅能充分辅助手术入路设计,还可以减少或避免术中对功能区的损伤,降低手术并发症。
注册完毕之后,手术器械在患者脑部的相对空间位置依赖于其发出的信号被导航仪空间定位设备的捕捉和处理,该位置能在电脑屏幕上实时显示,用于指引术者选择入路到达靶点/靶区域以及在靶点/靶区域的手术操作。
神经外科手术器械和导航仪空间定位设备之间的信号传递可以通过多种形式,包括机械(mechanic)定位、超声(ultrasound)定位、电磁(electromagnetic)定位和光学(红外,infrared)定位。现在神经导航中使用 最广泛的是光学定位,即将手术器械上的红外线发光二极管作为测量目标,CCD摄像机(charge-coupled device camera)作为传感器,从而计算出手术器械的位置。
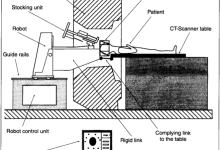
产品组成
1.工作站:由于需快速处理大量数据图像资料,神经导航系统一般采用UNIX操作系统,并配备高清晰度显示器。
2.定位装置:包括三维数字转换器和定位工具(如定位探头)。各种运用不同原理的三维数字转换器均要求能提供连续、实时的定位信息。目前主要的定位装置有:
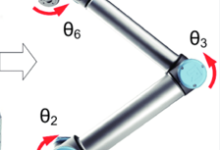
(1)关节臂定位装置
具有6个有位置觉的关节,通过应用三角学原理经计算机算出每个关节的角度位置,从而计算出探头尖的位置和角度,确定其空间位置。
(2)主动红外线定位装置
包括定位工具(如探头、标准手术器械如双极等)、发射红外线的二极管(infrared lighting-emitting diodes ,IRED),以及位置感觉装置(position sensor unit,PSU)。IRED小巧,可安装于探头及标准手术器械上,因此较关节臂更灵活轻巧,而且使手术器械起到多功能作用。把IRED安装在参考头架(reference arc)上,并把后者固定于头架上,可监测手术中头部与头架之间难以察觉的移动并可及时纠正,即所谓动态跟踪(dynamic referencing)。
(3)被动红外线定位装置
基本原理和方法与主动红外线定位装置相同。所不同的是定位工具无须连接电缆,而安装几个能反射红外线的铝合金小球。红外线发射装置和接收装置安装在手术野附近,由前者发出的红外线经小球反射后被接收器接收,再经工作站处理从而确定定位工具的空间位置。
(4)手术显微镜定位装置
把上述定位装置如红外线或关节臂感受器安装在手术显微镜上,通过激光测量镜片焦点的长度来确定手术显微镜的位置,即可将手术显微镜的焦点中心看作手持定位装置的探头尖,在显示器上同步显示出显微镜焦点的三维位置和动态跟踪。
配准方法
空间配准是神经导航系统最关键的技术,它通过匹配图像空间与患者空间之间的共同特征来计算两个空间之间的变换关系。 当前最常用的配准方法是点配准方法。在点配准方法中,手术前在病患头部粘贴可在CT或者MRI图像上清晰成像的人工标记物,并进行CT或者MRI扫描,建立图像引导空间,分别在图像空间和患者空间中获取这些标记物的坐标,并通过对齐对应标记物的坐标来计算两个空间之间的坐标变换关系。
另一种空间配准的方法是面配准方法。使用激光扫描仪获取病患空间中面部局部表面点云,然后与图像空间中提取的面部表面点云进行匹配,计算两个空间的坐标变换关系。面配准方法避免了点配准方法中人工标记物的移位或者脱落以及取点耗时较长的缺点。但是,由于扫描仪的扫描范围有限,只有部分面部表面点云参与配准,导致脑后部配准精度不高。
使用高精度的手持式扫描设备能够实现对整个头部的扫描,将获取的患者整个头部表面点云与图像空间提取的头部点云进行匹配,获取两个空间的坐标变换关系。这种方法提高了面匹配空间配准的精度和稳定性,解决了传统面匹配方法中脑后配准精度不高的问题。
为了减少脑移位或者脑变形引入的导航定位误差,可借助术中成像数据,使用非刚性配准算法来匹配并融合术中图像与术前图像,更新基于术前图像引导空间。 术中磁共振成像(iMRI)不仅能够在术中任意时刻为外科医生提供准确的解剖结构图像,高场强的磁共振还能进行术中功能成像,能够实现术中有效的实时导航,减少脑组织变形的影响。但是,iMRI安装和使用非常昂贵,操作也非常复杂,使用时将增加手术时间,影响手术工作流程。
超声成像价格低廉、实时性好,对手术流程影响小。借助 术中超声成像(iUS),利用可变形配准方法将术前MRI影像配准并融合到术中超声影像中,亦可实现术中导航影像的更新,补偿脑移位或者脑变形引入的导航定位误差。由于超声影像与术前MRI影像在图像特征以及维度上存在较大差异,使用传统的互信息方法来实现术中超声图像与术前MRI图像非刚性配准,效果欠佳。基于提取特征描述子的配准方法是将两种不同模态的图像由各自图像空间映射到同一特征空间,再在同一空间内使用单模态配准方法完成配准。基于自相似原理的模态无关特征描述子配准方法,例如miLBP(Modality Independent Local Binary Pattern)特征描述子、dLDP(Discriminative Local Derivative Pattern)特征描述子、BGA(Binary Gradient Angle Deor)特征描述子等,能够在不同模态的三维图像中稳定地提取图像特征且相似度计算时间短,在术中超声图像与术前MRI图像非刚性配准的效率和精度方面都具有明显的优势和潜力。
增强现实新技术
现有神经导航系统的导航模式是虚实分离的导航模式,即定位和引导信息显示在系统屏幕上,医生通过观察屏幕上的图像来进行手术操作。在这种导航模式下,手术过程中使用的位置信息显示在手术视野之外,医生为了观察手术器械相对于患者解剖结构的位置,需要在患者手术部位和屏幕之间来回切换视野,这不利于医生将注意力集中于患者头部进行手术,会干扰手术进程并加大导航定位误差。
为了解决这一问题,需要把导航引导空间同真实手术场景融合起来。增强现实(Augmented Reality,AR)神经导航系统,简称AR-IGNS,可以将病灶、重要解剖结构等虚拟信息同真实的手术场景相结合,并将导航信息显示在诸如头盔显示器(Head-Mounted Display, HMD)、增强镜片、AR窗口(AR Windows)、增强内窥镜、增强显微镜等显示设备上,以便医生视野不离开手术场景就可以获得直观准确的导航信息。
近年来,随着移动智能终端设备的迅速发展,借助平板电脑、智能手机等移动智能终端显示虚实结合的导航信息,引导医生手术,成为AR-IGNS的研究热点。这类新的导航模式可以使医生避免术中视野切换,并使导航信息更加容易理解,从而提高导航的精度和方便性。
技术局限
神经导航的精度是神经导航手术中最核心的问题。神经导航系统定位误差主要来源于两个方面: 一是图像空间中的图像与术中真实病患的解剖结构存在差异; 二是将探针的位置从患者空间变换到图像空间的过程中产生误差。其中,第一类误差的主要来源包括术中脑组织移位或者变形,EPI(Echo-Planar Imaging)扫描时的图像畸变,图像中反映的肿瘤边界不准确等。第二类误差的主要来源包括空间定位仪的跟踪误差,患者空间到图像空间的配准误差等。
由脑移位或者脑变形引入的导航定位误差目前尚未很好地解决。神经导航系统所依据的图像数据均为术前采集获得,手术过程中,由于开颅后脑脊液的流出、颅内压的改变、重力以及术中牵开操作和肿瘤切除等因素的影响会导致脑组织移位或变形。此时,基于术前数据所建立的用于引导术中操作的图像空间不能反映实时的解剖结构变化,导致术中神经导航定位精度下降,影响术中导航的可靠性。
神经导航术中脑组织结构可能因为各种原因造成移位,这样导航依据术前扫描和注册判定的手术器械位置与真实位置就可能存在差异,称之影像漂移(又称脑漂移,brain shift), 国外统计其发生率高达66%。为了解决这个问题,可以行术中也称实时核磁扫描(intraoperative or real-time MRI)来纠正偏差。另外,掌握尽量减少到达靶点前的脑脊液或囊液流失等实际操作经验可以明显减少漂移的发生,降低对手术精准的影响,这些技巧的获得有赖于充分的技术培训和临床摸索。
技术趋势
神经导航技术目前广泛应用于功能神经外科和颅内肿瘤等外科手术中,已经成为微创神经外科中不可或缺的重要工具。但是,导航定位误差,特别是由于术中脑移位或脑变形引起的导航定位误差,影响了术中导航的可靠性。在未来的导航系统中,通过整合术中影像数据,特别是术中超声数据,借助术中影像与术前影像的非刚性配准补偿脑变形引起的导航定位误差,能有效提高术中导航精度。增强现实神经导航系统引入了全新的导航模式,避免术中医生视野切换,使导航信息更加容易理解,手术工作流程更加顺畅。
除了传统的医学影像,术中成像新技术,例如拉曼光谱(Raman spectroscopy)、荧光(Fluorescence)和质谱(Mass spectrometry)等,能够在组织学或者更低层级上区分正常组织与肿瘤组织,为术中肿瘤切除提供更为精细的引导。此外,为了能在实时图像中进行手术,避免术中成像对手术进程的影响,神经外科手术机器人,例如MRI兼容的NeuroArm系统,正逐步开发出来。这类机器人能够集成术前、术中成像数据得到更精确的导航信息,并能为医生提供视觉、听觉、触觉反馈,指导医生操作。未来,需要更进一步的临床研究来确定机器人技术在神经外科手术中应用的可行性。
本文主要引用与参考文章:
《简述神经导航的原理、应用及其他》-首都医科大学宣武医院功能神经外科- 乔梁李勇杰;《神经外科手术导航系统改变传统的开颅模式》-章琛曦,复旦大学基础医学院数字医学研究中心副教授、宋志坚,复旦大学基础医学院数字医学研究中心主任、教授;《什么是神经导航》