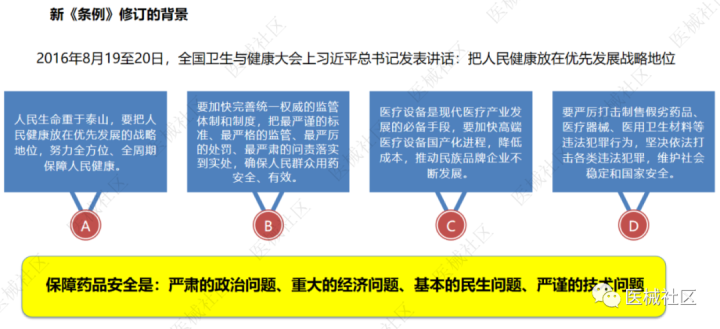
第一阶段(1950-1978),多项技术突破并实现国产
我国医疗器械从0到1的多项技术突破十分不易,从极其困难的战争时的“背上工厂”、技术封锁、工业非常薄弱、到全行业开展以革新工艺、改进设备为中心的艰苦历程。也是医疗器械生产从手工操作逐步提高到机械化程度的转化过程。通过对多项技术的突破,为我国医疗器械全面高速发展奠定了坚实基础。但由于医疗器械产业处于萌芽和探索发展期,在监管方面还未正式形成相关的法规性文件。
1、我国近代医疗器械的发展溯源
清末、民初(公元 19 世纪末、20 世纪初)西方医疗技术开始以较快的速度传入中国,西医的医疗器械也随之进入。但是,直至 20 世纪 50 年代之前,中国医疗器械的生产发展缓慢,工艺技术不高,经营的品种很少。那时,主要产地是北京、上海、山东和辽宁等省市,全国仅有70 家小修造厂,从业人员不足 1200 人,品种和产量都很少。国内所需的医疗器械,甚至是体温表、注射器、听诊器等,也都依赖进口。
20 世纪 40 年代,在极其困难的战争条件下,面对着严峻的形势,华东地区胶东军区卫生部在山东成立制药厂,主要生产部队急需的军用药品和医疗器械。1943年11月,由胶东军区司令员许世友亲自谋划组建,从胶东军区卫生部所属单位抽调18名医务人员在牙前县后垂柳村成立了制药小组,进行药品的研制和生产。同时,也生产一些简单的手术器械。
1948 年迁至山东张店,扩大为华东新华制药厂,下设 6 个厂,其中第二厂是医疗器械厂、第五厂是敷料厂、第六厂是玻璃厂。第二厂有职工 287 人,生产医用镊、止血钳等。后来,在东北也建立了医疗器械厂,并在 1949 年11月扩建为东北医疗器械厂,有职工 331 人,生产刀、剪、钳、镊4个品种的医疗器械。据统计,截至 1949 年 10 月,全国的医疗器械年产量仅为人民币 200 万元。

2、我国第一台X线光机研制成功
1952年9月25日,国内第一台200毫安医用X光机在上海医学院放射学教研室主任兼附属中山医院放射科主任荣独山协助下,由上海精密医疗器械厂(现在的西南医用设备有限公司)前身华东工业部器械二厂的工程师严家莹、张熙明和副厂长闻尧、车间主任朱德鑫等一起研制成功,安装于中山医院内进行试用,当时定名为“国庆号”。1959年年底该厂还试制成功400毫安大型X射线机。从此,我国终于实现了X光机的成批生产,医疗事业因此而大大前进了一步。此外,1960年上海精密医疗器械厂与长春光学所合作研制国内第一台20万倍电子显微镜。

1958年,万东医疗试制成功了首台固定阳极管的200毫安X射线机和旋转阳极管的400毫安X射线机,并实现批量生产。
1954年,上海心康工业社研制一台心电图机,但性能不稳定,操作复杂,未能推广。1958年,宇宙医用电子仪器厂研制成功409型心电图机,为生物电诊疗技术的发展迈出了重要一步。当年生产202台,结束了中国心电图机完全依赖进口的历史。60年代末过渡到晶体管心电图机,70年代后发展成为集成电路型的,80年代初产品引入微处理机。
1956年2月8日,天谊医疗器械厂研制成功国产第一台内窥镜鼻咽镜。至1960年,运用光学内窥技术已研制成功膀胱镜、腹腔镜、气管镜、直肠镜。这一时期的内窥镜均为硬管。1968年10月,用正方形排列、层叠法工艺研制成功国内第一根光学纤维传像束。1970年,研制成功用电珠作照明的第一台国产纤维胃镜。

5、我国第一台血细胞计数仪研制成功
1961年,上海的工程师张根福通过对进口仪器的剖析,参考国外文献与国内科研单位协作,生产出国内第一台血细胞计数仪,随后南京无线电原件总厂、济南三联电子仪器厂、北京生化仪器厂先后生产了各种型号血细胞分析仪。但最终因仪器质量和多种原因淡出了医疗市场。直到1998年,迈瑞推出中国第一台三分类血细胞分析仪,一直高居不下的进口垄断格局终被打破,价格逐步下降。
6、我国第一台超声诊断设备研制成功
1962年中国第一台超声波人体诊断仪在汕头超声仪器研究所(现汕头市超声仪器研究所股份有限公司)研制出来,属全国首创。于1963年批量生产,推开了中国超声诊断设备的自主研发之路,打响了“汕头超声”这块金字招牌。1964年CTS-5型—当时全国唯一的A型医用超声诊断产品又在汕头被成功研制出来,并在此后的20年间累计销售3万多台。

1963年,在当时国际条件对我国处于封锁状态,国内医疗工业非常薄弱的情况下,蔡用之教授克服重重困难,不断试探摸索,开始了研制国产人造心脏瓣膜。1964年初,蔡教授终于联系到上海医疗器械研究所与上海硅橡胶研究所,按中国人的体格设计出人造球型心脏瓣膜,经过一年多的动物实验,在条件简陋的情况下,克服了各种困难,做了将近200多条犬的大型动物实验,成活率达70%。1965年6月,我国成功研制出第一代国产笼球型人造心脏瓣膜,并于当年6月12日应用于临床并成功地实施了中国首例人造心脏瓣膜置换术,标志着我国瓣膜外科进入了一个新的阶段。



第二阶段(1978-1998),多项大型设备核心技术突破
1978年,我国医疗器械生产厂家增加到430家,在职员工增加到10万人,生产品种也大幅度上升,为改革开放后的产业发展打下了坚实的基础,至1998年经过20年的快速发展,我国医疗器械产业在全国已初见规模。到1990年全国生产企业职工总数达到14万人,年工业总产值约30亿人民币,平均年递增率达14.7%,还出口到20多个国家和地区,出口年总产值达2亿多人民币。1991-1995年工业年产值递增达到30%,远高于国民经济发展水平。(数据:百度)
从前20年的计划模式正式过渡到发展模式。在产业规模的不断扩张和快速发展之下,1996年9月,原国家医药管理局发布了我国第一部关于医疗器械的监管法规:《医疗器械产品注册管理办法》(国家医药管理局令第16号),正式将医疗器械纳入到监管中来。
1、我国成为全球第四个能生产颅脑CT的国家
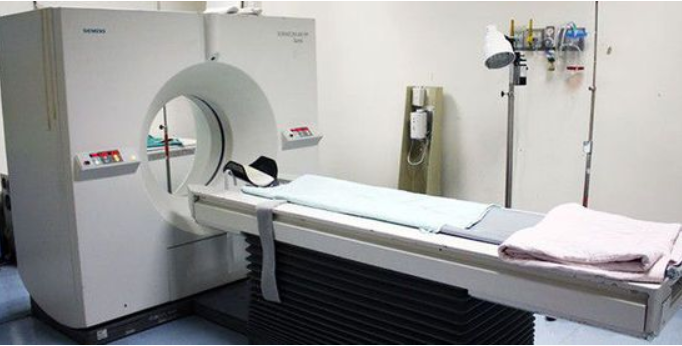
1963年,美国物理学家科马克发现人体不同的组织对X线的透过率有所不同,在研究中还得出了一些有关的计算公式,这些公式为后来CT的应用奠定了理论基。 1979年,颅脑CT国家重点项目在上海医疗器械研究所立项,该项目组共有约 200人,包括清华大学、5703厂等来自全国各地的协作单位人员。样机是研究CT的关键,当时全国第一台颅脑CT由华山医院从日本进口,国务院指派交通部出资60万美元高价买入。1983年5月30日,中国第一台大型X线断层颅脑扫描装置在上海通过技术鉴定,它能够有效地诊断脑肿瘤、脑出血和脑栓塞等许多脑疾病,经过246个例病的临床使用,证明效果良好。成为全球第四个(美国、日本、英国、中国)能生产颅脑CT的国家。
2、我国第一台磁共振成像系统MRI诞生
自20世纪80年代以来,MRI技术以极快的速度得到发展,极大地推动了医学、神经生理学和认知神经科学的迅速发展。1980年,世界第一套核磁共振成像系统原型机诞生于Fonar公司。1984年起,MRI开始进入商业化市场。
1984年,国家组织相关研讨会,由时任国家计委、科委的领导宋平、宋健签字同意,为带动国内相关学科的发展,决定自主研发核磁共振成像系统(MRI)
。1984年,国家代表团赴美国调研,分别到Technicare、 Fonar、 Analogic等公司实地考察。与此同时由电工所派出技术小分队,赴硅谷美籍华人王守田创办的公司学习超导磁体相关的设计制造技术。1985年,国家代表团第二次来到美国,中科院MRI项目筹建小组与Analogic公司商谈合资细节。

1986年底,中国科学院通过与美国高科技公司(Analogic Corporation)合作,双方合资在深圳蛇口成立了安科高技术股份有限公司。举国之力,在研发设备一无所有,绝大多数人连MRI照片都没见过的条件下,以陶笃纯、赖景明、朱维衡、冯蕴深、聂彤、张超骥、孔令圻、董佩刚、周细统、董承玉、周荣琮、董增仁、曾晓庄等人为主的科研团队,经过艰苦努力,仅用一年半时间,就成功开发出中国第一台磁共振成像系统:场强为0.15T的永磁型MRI―ASP-015样机。接着,又花了一年半时间进行系统改进、生产准备和临床试验,终于在1989年12月通过了国家科委主持的鉴定,中国第一台磁共振成像系统正式在安科诞生
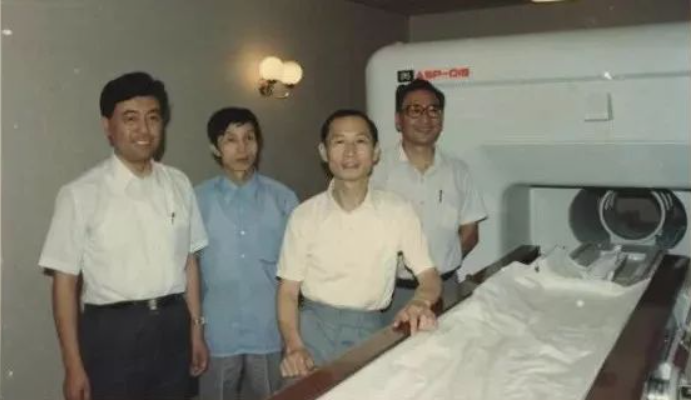
3、我国第一台CT机研制成功
20世纪80年代,我国医用CT机(计算机X线断层摄影)急缺,但CT机技术被美、德、日三国垄断,只能依靠进口,导致国外的二手CT机乘虚而入,竟然一度占据了国内CT机的70%的份额。
1987年9月,沈阳市卫生局花了50万美金高价购买的CT机(计算机X线断层摄影),经过天津外贸总公司从美国公司引进,但由于组装的美国工程师接错电源彻底报废了。事发之后,工程师落荒而逃,美国公司也渺无音讯,面对电路板几乎全部烧毁的CT机,沈阳卫生局协同沈阳市第八医院花巨资邀请的各类修复专家都手足无措。东北工学院(现东北大学)年青教师郑全录、李甲递考察了被烧毁的CT机后向校领导表示:我们可以修复这台机器!他俩积极钻研业务,加之动手能力强,花了三个月时间更换芯片,再经过艰难的调试,最终修复好了这台CT机。

1989 年8月19日,陆钟武院长主持召开了主题为“CT机研制可行性”的党政联席会。会上,陆钟武明确指出,研制CT机对东北工程学院的发展具有重大的战略意义,于是,1989年立项并得到国家科技“火炬计划”的支持。
1994年7月,我国第一台CT科研样机在东北大学研制成功,1997年CT项目并入东软集团,东软利用自己的软件优势开始了CT制造技术攻关,“用软件替代硬件”的路径,结合现代电子技术、集成技术、IT技术等,于1997年推出国内首台CT。
1991年,由年轻的东北大学教授刘积仁在中国东北大学创立了东软,1998年东软医疗系统有限公司正式成立,国产CT首次实现产业化,并正式向市场推出东软CT-C2000。随后20余年里,东软也努力守住了中国CT开创者的地位,相继研发制造中国第一台螺旋CT、16层CT、64层CT、128层CT、第一台极速能谱CT、第一台256层宽体能谱CT、以及512层全景多模态CT。(数据:搜狐)
4、我国第一部监管法规诞生
1996年9月6日,原国家医药管理局发布了我国第一部关于医疗器械的监管法规“《医疗器械产品注册管理办法》(国家医药管理局令第16号)”,全文共17条,并规定任何一种医疗器械进入中国市场,均采用统一的医疗器械注册登记和审查。第一类由省级办理产品登记注册,二类和三类由国家实行分阶段注册审查。即第一阶段为试产注册,主要审查产品的安全性和有效性,试产注册后的第七个月开始,生产者即可申请准产注册。第二阶段为准产注册,主要审查企业质量保证能力。准产注册有效期为四年,到期应复审换证。处罚力度为10000元以上30000元以下。
第三阶段(2000-2008),医疗器械监管驶入法治轨道
我国第一部《条例》第276号令的颁布实施,正式开启我国医疗器械产业监管模式。有数据显示,至2010年我国医疗器械市场总体产值突破了1000亿元,规模居世界第二,2011年全年更是达到了1354.1亿元,特别是某些中低端医疗器械产品,我国的产量以及产值都为世界第一。威高、双鸽、康莱德、蓝帆医疗、三鑫医疗、江西洪达等国产产品不仅占据了国内市场大多数份额,在国际市场也占据举足轻重的地位。
2002年12月中国科学院长春光机与物理研究所自行研制的我国第一台全自动生化分析仪已经通过鉴定。该产品整体性能达到了国外同等产品水平,填补了国内空白,形成了12项技术专利,研制成功了全自动生化分析仪。
2003年,我国第一台拥有自主知识产权的BS-300全自动生化分析仪由深圳迈瑞研制成功并投入临床应用。至此以后,我国医疗器械产业正式进入高速发展阶段,科研基础和生产技术逐渐丰富和完善起来,更多品类的医疗器械国产第一、国内首创诞生。

2、我国医疗器械早期发展过程中存在的乱象
我国医疗器械历经了前30年计划阶段、20年的发展阶段,在这前50余年,国家将重心放在医疗器械的技术突破、产业规模之上。回顾发展历史,在这两大重要阶段,硕果累累,已初步形成医疗器械一定产业规模和技术积累,也为往后10年的医疗器械高速发展打下了坚实的基础。
但在这段时期发展中,我国几乎未形成有效的监管体系,导致产业监管缺失而造成严重乱象。在2000年之前,我国医疗器械生产企业规模近5000家,并以年均18%左右的增长速度发展,年产值约300亿元。另外,有近千家海外公司向我国出口近百种(类)医疗器械,年销售额10多亿美元,其中一些质量低劣的医疗器械流入市场和医疗机构,甚至还有二手设备和报废设备,如象二手CT,竟达到现有CT的一半。令人震惊的是二手设备中劣质CT机竟占1/2以上,甚至不能成像、开机。国内医疗器械合格率长期在70%左右俳徊,这些不仅严重扰乱了我国医疗器械市场的正常秩序,而且给使用的医疗卫生单位和患者造成无法估量的损失。这不仅严重威胁广大病人的生命与健康,而且也影响着我国医疗器械产业的健康安全。(来源:医药卫生科技)
3、我国医疗器械监管的第一部上位法正式诞生
医疗器械作为医疗服务中诊断和治疗的重要工具,其安全性、有效性直接关系 医疗效果和病人的生命安全,但长期以来由于缺乏相关的法规,致使有关部门和使用单位难以对医疗器械实施严格的管理和监督,医疗器械研究、生产、流通、使用诸环节存在不少问题,甚至乱象问题相当严重。
为此,2000年1月4日,由国务院第24次常务会议审议通过的《医疗器械监督管理条例》第276号由朱镕基总理签发颁布,于2000年4月1月正式实施。初步建立了以上市前审批、生产企业监管和上市后监管为核心的“三位一体”监管体系。这也标志着,我国医疗器械的监督与管理结束无法可依的历史,自此驶入法治化轨道。
4、我国医疗器械监管体系正式趋于完善
随着2000年《医疗器械监督管理条例》第276号条例的颁布实施,配套的法规也随之不断推出,包括以下主要法规文件:
-
医疗器械注册管理办法(局令第16号) (2000-04-05)
-
医疗器械分类规则(局令第15号) (2000-04-05)
-
医疗器械生产企业质量体系考核办法(局令第22号) (2000-05-22)
-
一次性使用无菌医疗器械监督管理办法(暂行)(局令第24号) (2000-10-13)
-
医疗器械标准管理办法(试行)(局令第31号) (2002-01-04)
-
医疗器械临床试验规定(局令第5号) (2004-01-17)
-
医疗器械说明书、标签和包装标识管理规定(局令第10号) (2004-07-08)
-
互联网药品信息服务管理办法(局令第9号) (2004-07-08)
-
医疗器械生产监督管理办法(局令第12号) (2004-07-20)
-
医疗器械经营企业许可证管理办法(局令第15号) (2004-08-09)
-
医疗器械召回管理办法(试行)(卫生部令第82号) (2011-05-20)
-
医疗器械广告审查发布标准(局令第 40 号 )(2009-04-28)
-
医疗器械广告审查办法(局令第65号) (2009-04-07)
5、迈瑞医疗的发展和崛起
20世纪90年代的中国,医疗器械技术水平十分落后,国外医疗器械几乎占据了国内市场90%的份额。当时国内企业基本上都是香港公司的二级代理,生意并不难做。于是,1991年迈瑞正式在深圳成立,前期以代理监护仪为主。创业之初的迈瑞无法在资金实力上与香港代理公司抗衡,在多次不愉快经历之后,创始人开始意识到自主开发产品的重要性。但真正促使迈瑞放弃代理、专心自主研发的转折,是1997年华登国际投资的介入。
2006年9月26日,迈瑞医疗在资本市场上迎来了它的高光时刻:迈瑞在美国纽约证券交易所上市,成为首家登陆美国证券市场的中国医疗器械公司。曾经的迈瑞也历经过从模仿到自主知识产权的,而最重要、最成功的一次并购,是2008年并购了Datascope。创办于1964年的Datascope,在美国监护仪市场排名仅次于GE、飞利浦等巨头。收购后,迈瑞在美国300床以下中小医院监护市场占据50%市场份额。
而后的故事是,因美国市场估值过低,2016年迈瑞医疗从纽交所退市,当时估值只有33亿美元。2018年,迈瑞回归深交所创业板挂牌上市,成为当时创业板最大规模的IPO,上市首日市值就达到854亿元。2020年受疫情刺激,迈瑞市值一路飙升,一度逼近6000亿元。东方财富Choice数据显示,2020年迈瑞的机构接待总量由2019年的856家次激增到3802家次,超越此前连续四年位居榜首的海康威视,成为最受机构青睐的公司。(来源:亿欧网)
第四阶段(2008-2018),医疗器械监管重大改革举措
我国医疗器械行业整体水平不断提升,新技术不断涌现,但现有监管体系与产业发展矛盾突显,如何制定更适合中国国情的监管法规体系,在规范产业合规化的同时,更能助力产业的良性发展,是十分艰巨的工程,在历经6年的深度调研、探索,终于发布了全新的2014版条例、与2000版相比,发生了翻天覆地的变化,引入了全新的监管思路和策略,是我国医疗器械监管历程的一次革命性改革。
1、我国医疗器械产业发展模规变化
2000年版《条例》发布时,全国医疗器械生产企业不到5000家,年产值约300亿元;到2016年,生产企业已达15343家,年产值超过5000亿元。生产企业主要分布在长三角、珠三角、环渤海地区,其中广东、江苏、浙江、上海、山东和北京等六省市的医疗器械生产企业数量占全国总数的58.5%。
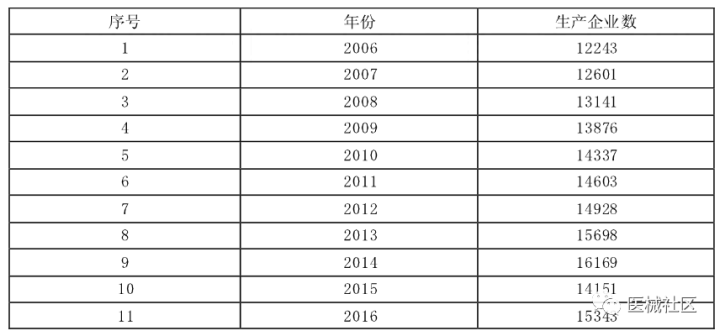
在10年的发展过程中,我国医疗器械产业规模和技术水平,以及潜在风险都发生了很大变化。CT装置、磁共振装置、彩色B超、直线加速器、血管支架、人工关节等都已经实现国产化。新产品不断涌现,高风险产品快速增加。
自 2006 年以来我国医疗器械产业发展迅速, 医疗器械生产及经营企业数量总体上升趋势较快。与此同时,医疗器械产业整体创新能力不断提升,创新产品的研发投入和产出均呈高速增长状态,产业整体竞争能力不断增强。产业在多元化高速发展,变化如此之快,是现有监管体系与之难以匹配的。条例的修订工作势在必行,监管思路顺势改变。因此,2006年,国家药监局就启动条例修订工作,期间进行了30多项专题调研,涉及产品注册、日常监管、不良事件监测、产品召回等。经过广泛征求意见和多次讨论修改,2008年3月,《条例》修订送审稿报送原国务院法制办。
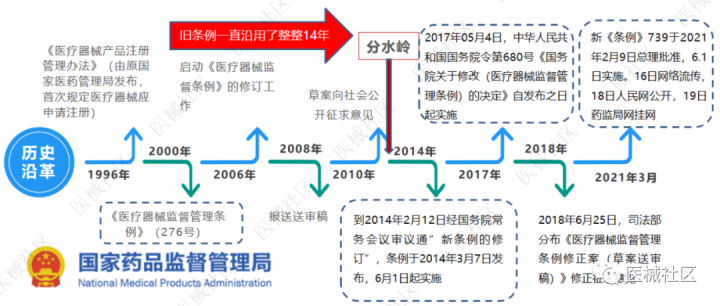
回看2000版条例,要求生产企业需要先获得医疗器械生产许可证,再申请医疗器械注册证。这对初创企业带来极大的经济负担,长时间背负厂房闲置的租金成本压力,极大阻碍医疗器械的创新发展。然而,为顺应医疗器械产业的有利发展,制定科学完善的监管体系,从2008年递交送审稿,到2014年《医疗器械监管管理条例》第650号令发布,期间耗时6年。而2000版条例也因此沿用了14年之久,可见,我国医疗器械产业发展速度和变化之快。
2000版条例下的保姆式监管和政府背书形态在2014年6月1日正式终结,这也是我国医疗器械监管发生革命性变化的分水岭。2014版条例与2000版条例最大变化包括审评审批制度的大胆改革,由原来的先申请生产许可证+医疗器械注册证,改为先申请医疗器械注册证+后医疗器械生产许可证;由原来的临床试验,改为三种临床评价方式,包括免于临床试验的评价、同品种对比和临床试;这些大胆尝试的监管改革,包括简政放权、优化审评审批制度、风险管理和社会共治,充分反应我国医疗器械监管水平的大幅提升,也基本实现与国际接轨的监管趋势,为医疗器械产业国际化发展注入更多新动力。
根据2014版条例及国家有关文件精神,药监部门先后出台了16部有关医疗器械监督管理的部门规章,其中,2014年就制定了14部。此外,为配套条例和规章的有效实施,在财政部及标委会的支持下,加强了医疗器械标准的修订工作,截止2016年,共发布了1465项医疗器械标准、180多项医疗器械技术指导原则和一系列规范、指南性文件。基本实现我国医疗器械常规产品的全覆盖,进一步完善监管体系和提升监管水平。
第五阶段(2018——),医疗器械监管科学监管时代到来
改革开放40多年来,我国医疗器械产业快速发展,建立了比较完备的医疗器械生产供应体系,实现了历史性跨越。今天,我国医疗器械产业已进入蓬勃发展的“黄金期”。据前瞻产业研究院数据显示,2010年至2019 年,我国医疗器械产业以年复合增长率 19.55%高速增长。2019年全国医疗器械主营业收入达到7200多亿元,约占全球医疗器械市场规模的20%。2020 年更是以35.24%的增速超速发展,产业规模达8500 亿元人民币。
我国医疗器械生产企业数量自2015年以来,保持逐年增加趋势。截至2020年底,全国医疗器械生产企业数量达26465万家,其中第一类医疗器械15536 家,二类13011家,三类2181家。
全国共有二类和三类医疗器械经营企业 898591 家,其中,仅经营二类医疗器械产品的企业 583198 家,仅经营三类医疗器械产品的企业 77021 家,同时从事二、三类医疗器械经营的企业 238372 家。
2、趋于完善的医疗器械监管体系再次升级
医疗器械产业发展迅猛,但在旧条例下仍面临诸多监管方面的问题和缺陷,与国家长远发展规划战略和产业创新不符。2015年8月,国家发布了《国务院关于改革药品医疗器械审评审批制度的意见》44号,提出了改革的主要目标和任务。2017年10月8日,两厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》42号,并提出了36项改革举措,其中针对医疗器械提出了9项重大改革方向。同时,2017年3月30日,国务院印发了《全面深化中国(上海)自由贸易试验区改革方案》和2017年5月11日国家药监局发布《关于药品医疗器械创新实施药品医疗器械全生命周期的相关政策》,后国家局分阶段批复由上海率先实施、分批在全国22个省市开展医疗器械注册人制度的试点工作,这一重大的、颠覆性改革举措,在3年多时间取得了卓著成果。这一系列的精神文件和经验成果,为医疗器械监管改革和未来的监管手段给出了方向和思路,也为再次修订新条例提供了重要依据。
3、新条例下的医疗器械监管更具有挑战
新《医疗器械监督管理条例》第739号令经过两年多的修订和审议,终于在2021年发布,于2021年6月1日实施。同时,与之配套的部门规章征求意见稿逐步公开向社会征求意见,这又将是新一轮的法规交替和监管改革。通过对新条例的学习,未来监管趋势将会发生翻天覆地的变化。整个行业都将面临着挑战,包括行业发展、企业管理和从业人员专业素养等。
创新发展是要家重点方向,对整个产业都是机会和红利,如何抓住政策的红利?放开自检后企业是否能够真正具备自检能力?临床评价路径优化后对产品研究深度?备案人、注册人为责任主体如何做好全生命周期管理?上市后不良事件监测和UDI追溯体系?专业化、职业化检验队伍的审核形式如何?以及如何构建合规化体系和法规成本预算?
基于风险管理、动态分类调整、两大分中心、科学监管研究等一系列的信号,都标志着,未来的医疗器械监管体系更加科学化、标准化、国际化,监管手段更加动态、创新。而我们也将伴随着,在科学监管时代一路成长。
我国医疗器械从1950年-1978年走过了计划模式,在极其困难的条件下,不断突破技术壁垒,为医疗器械产业发展打下了坚实基础,以发展为首的政策趋动,并没有相关的监管体系。从1978年-1998年走过了发展模式,医疗器械市场环境落后、竞争并不算激烈。如今很多企业都在这时间成立并不断发展壮大起来,包括龙头一哥的迈瑞和多家上市公司;在此期间发布了中国的第一部《医疗器械注册管理办法》,对医疗器械的上市准入进行了规范管理。从1998年至2008年逐步形成了监管模式,医疗器械经过前50余年的发展,已初具产业规模,生产企业高速增长,但整体市场环境呈小、乱、差现象,国家开始大力整治和建立监管体系,在《医疗器械监督管理条例》第276号令发布并实施后,配套发布了系列相关部门规章;但由于医疗器械的发展速度远超乎想象,不断涌现新产品、新技术和新方法,现有的监管方式与之不相匹配,因此,从2006年开始启动了条例的修订工作。2008年-2018正式形成社会共治的监管模式,2000版条例实施14年,也助推医疗器械产业高速发展14年,国产医疗器械发生大变局。2014年版条例正式迎来一次大革新,配套一系列的规章、指导原则、指南性文件、标准等随之而来,医疗器械监管体系趋于完善、整体监管水平提升,与国际接轨。科学监管研究计划正式启动,更多国产化前沿新技术、新材料等涌现,并占据国际领先地位。2018年之后,我们医疗器械再一次改革创新,在2021版新条例和政策助推之下,创新是本次改革的重要方向,我国医疗器械将迎来再一次飞跃,创新水平、中国制造将有望占据国际领先地位。
本文耗时10个小时,通过核对、查证才得以完成,其中有部分资料来自网络检索公开材料,内容并非全部原创,引用部分未查询到作者,因此,在本文中未注明作者,但我在此默默感谢前辈输出的历史参考资料。整理此文的目的,一方面是为巩固本人对我国医疗器械发展和监管历程的理解和认知,另一方面,分享给对此感兴趣的朋友阅览。为让各位朋友直观了解监管部门的改革历程和监督管理条例的修订过程,特意梳理了两张PPT。如果本文对你学习了解医疗器械的历史沿革有帮助,希望能给予支持和转发。

版权声明:本文采用知识共享 署名4.0国际许可协议 [BY-NC-SA] 进行授权
文章名称:《回顾我国医疗器械监管历史沿革》
文章链接:
https://www.qixiezhixin.com/11872.html
本站所有非原创内容均来自转载或分享,仅供学习交流,不用于商业用途。如无意中侵犯了知识产权,请来信告知,将立即配合删除。Email:qixiezhongguo@qq.com