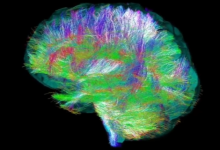
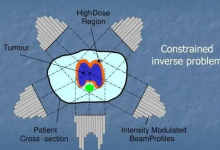
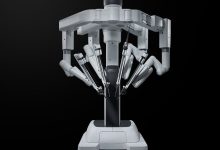
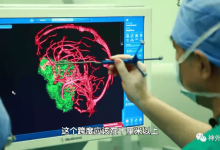
目前已知最早的医疗器械是战国时期的青铜“砭镰”,中国也是世界上目前已知最早的手术刀,距今3400年;后续广为人知的针灸疗法所使用的银针,也可归于医疗器械。1843年,上海开埠,医疗器械同其它商品一起进入中国;至20世纪初,我国医疗器械市场几乎完全被外商独占。90年代之前,在中国的计划经济体制下,医疗器械尚未有统一的定义,而是根据类别的不同,按照不同大类的工业产品由相关的工业部门分别管理。
中国医疗器械简史
1994年中国医疗器械产品认证委员会及其中国医疗器械质量认证中心成立;1996年8月12日国家医药管理局发布YY/T0287、YY/T0288两个行业标准,并于1997年2月1日年发布实施;
1996年9月6日,原国家医药管理局颁布16号令,发布了《医疗器械产品注册管理办法》,与1997年1月1日执行;
1999年国药管械[1999]84号《关于实施医疗器械质量体系认证工作的函》,医疗器械质量体系认证工作一并划归“认证中心”(中国医疗器械产品认证委员会及其中国医疗器械质量认证中心)
2000年1月4日 国务院令第276号《医疗器械监督管理条例》,自2000年4月1日起施行;
2000年04月05日 国家药品监督管理局局令第15号《医疗器械分类规则》,自2000年4月10日起执行;
2000年4月10日国家药品监督管理局局令18号,颁布了《医疗器械生产企业监督管理办法》和《医疗器械经营企业监督管理办法》,2000年4月20日起实施许可证制度(收费、年检);
2000年05月22日,国家药品监督管理局颁布局令第22号,发布《医疗器械生产企业质量体系考核办法》,自2000年7月1日起施行;
2000年08月18日,国药管械[2000]367发布《无菌医疗器具生产管理规范》(YY0033-2000 无菌医疗器具生产管理规范(代替YY/T0033—90)),自2000年9月15日起实施;
2001年04月04日,药监械函[2001]13号发布关于编制《医疗器械分类目录》的通知;
2001年07月25日,国药监办[2001]357号《印发关于规范体外诊断试剂管理的意见的通知》,分为随机和一般,体外诊断试剂按药品管理,随机体外诊断试剂归医疗器械司管理;
2002年09月17日,国药监办[2002]324号《关于体外诊断试剂实施分类管理的公告》,体外生物诊断试剂按药品进行管理,体外化学及生化诊断试剂等其他类别的诊断试剂均按医疗器械进行管理。体内诊断试剂一律按药品管理。2002年10月1日起实施。
2002年11月07日,国药监械[2002]400号《关于开展医疗器械不良事件监测试点工作的通知》,开展医疗器械不良事件监测工作;
2003年03月18日,发布《关于部分医疗器械产品分类界定问题的通知》(国药监械[2003]98号),分类界定源头;
2003年06月20日,国食药监械[2003]140号《关于划归医疗器械管理的体外诊断试剂注册事宜的通知》,归于医疗器械管理的体外诊断试剂2004年7月1日起不再按原药品批准文号上市销售、使用。
2003年09月17日,国食药监械[2003]243号,发布 YY/T 0287-2003 《医疗器械 质量管理体系 用于法规的要求》,自2004年4月1日起实施;
2004年01月17日,国家食品药品监督管理局颁布局令第5号,《医疗器械临床试验规定》自2004年4月1日起施行;
2007年07月02日,食药监办[2007]122号《关于印发医疗器械检验机构注册检验报告统一格式的通知》,注册检验报告格式统一;
2007年4月19日,国食药监械〔2007〕229号《体外诊断试剂注册管理办法(试行)》
2007年04月28日,国食药监械[2007]239号关于印发《体外诊断试剂质量管理体系考核实施规定(试行)》的通知,发布《体外诊断试剂质量管理体系考核实施规定(试行)》、《体外诊断试剂生产实施细则(试行)》和《体外诊断试剂生产企业质量管理体系考核评定标准(试行)》,自发布之日起实施。
2007年05月23日,国食药监市[2007]299号《关于印发体外诊断试剂经营企业(批发)验收标准和开办申请程序的通知》
2007年10月16日,食药监办[2007]205号《关于发布医疗器械产品注册技术审查指导原则的通知》开展了医疗器械产品注册技术审查指导原则;
2009年12月16日,国食药监械[2009]833号发布《医疗器械生产质量管理规范(试行)》,自2011年1月1日施行。
至此,大致框架已经建好。